El agua químicamente pura es un liquido inodoro e insípido; incoloro y transparente en capas de poco espesor, toma color azul cuando se mira a través de espesores de seis y ocho metros, porque absorbe las radiaciones rojas. Sus constantes físicas sirvieron para marcar los puntos de referencia de laescala termométrica Centígrada. A la presión atmosférica de 760 milímetros el agua hierve a temperatura de 100°C y el punto de ebullición se eleva a 374°, que es la temperatura critica a que corresponde la presión de 217,5 atmósferas; en todo caso el calor de vaporización del agua asciende a 539 calorías/gramo a 100°.
A consecuencia de su elevado calor especifico y de la gran cantidad de calor que pone en juego cuando cambia su estado, el agua obra de excelenteregulador de temperatura en la superficie de la Tierra y más en las regiones marinas.
El agua se comporta anormalmente; su presión de vapor crece con rapidez a medida que la temperatura se eleva y su volumen ofrece la particularidad de ser mínimo a la de 4°. A dicha temperatura la densidad del agua es máxima, y se ha tomado por unidad. A partir de 4° no sólo se dilata cuando la temperatura se eleva,. sino también cuando se enfría hasta 0°: a esta temperatura su densidad es 0,99980 y al congelarse desciende bruscamente hacia 0,9168, que es la densidad del hielo a 0°, lo que significa que en la cristalización su volumen aumenta en un 9 por 100.
Las propiedades físicas del agua se atribuyen principalmente a los enlaces por puente de hidrógeno, los cuales se presentan en mayor número en el agua sólida, en la red cristalina cada átomo de la molécula de agua está rodeado tetraédricamente por cuatro átomos de hidrógeno de otras tantas moléculas de agua y así sucesivamente es como se conforma su estructura. Cuando el agua sólida (hielo) se funde la estructura tetraédrica se destruye y la densidad del agua líquida es mayor que la del agua sólida debido a que sus moléculas quedan más cerca entre sí, pero sigue habiendo enlaces por puente de hidrógeno entre las moléculas del agua líquida. Cuando se calienta agua sólida, que se encuentra por debajo de la temperatura de fusión, a medida que se incrementa la temperatura por encima de la temperatura de fusión se debilita el enlace por puente de hidrógeno y la densidad aumenta más hasta llegar a un valor máximo a la temperatura de 3.98ºC y una presión de una atmósfera. A temperaturas mayores de 3.98 ºC la densidad del agua líquida disminuye con el aumento de la temperatura de la misma manera que ocurre con los otros líquidos.
Por otra parte, hay sustancias que tienden a tomar el vapor de agua de la atmósfera y se llaman hidrófilas y también higroscópicas; la sal se dice entonces que delicuesce, tal es el caso del cloruro cálcico.
El agua químicamente pura es un compuesto de fórmula molecular H2O. Como el átomo de oxígeno tiene sólo 2 electrones no apareados, para explicar la formación de la molécula H2O se considera que de la hibridación de los orbitales atómicos 2s y 2p resulta la formación de 2 orbitales híbridos sp3. El traslape de cada uno de los 2 orbitales atómicos híbridos con el orbital 1s1 de un átomo de hidrógeno se forman dos enlaces covalentes que generan la formación de la molécula H2O, y se orientan los 2 orbitales sp3 hacia los vértices de un tetraedro triangular regular y los otros vértices son ocupados por los pares de electrones no compartidos del oxígeno. Esto cumple con el principio de exclusión de Pauli y con la tendencia de los electrones no apareados a separarse lo más posible.
Experimentalmente se encontró que el ángulo que forman los 2 enlaces covalentes oxígeno-hidrógeno es de 105º y la longitud de enlace oxígeno-hidrógeno es de 0.96 angstroms y se requiere de 118 kcal/mol para romper uno de éstos enlaces covalentes de la molécula H2O. Además, el que el ángulo experimental de enlace sea menor que el esperado teóricamente (109º) se explica como resultado del efecto de los 2 pares de electrones no compartidos del oxígeno que son muy voluminosos y comprimen el ángulo de enlace hasta los 105º.
Las fuerzas de repulsión se deben a que los electrones tienden a mantenerse separados al máximo (porque tienen la misma carga) y cuando no están apareados también se repelen (principio de exclusión de Pauli). Además núcleos atómicos de igual carga se repelen mutuamente.
Las fuerzas de atracción se deben a que los electrones y los núcleos se atraen mutuamente porque tienen carga opuesta, el espín opuesto permite que 2 electrones ocupen la misma región pero manteniéndose alejados lo más posible del resto de los electrones.
La estructura de una molécula es el resultado neto de la interacción de las fuerzas de atracción y de repulsión (fuerzas intermoleculares), las que se relacionan con las cargas eléctricas y con el espín de los electrones.
De acuerdo con la definición de ácido y álcali de Brönsted-Lowry, los 2 pares de electrones no compartidos del oxígeno en la molécula H2O le proporciona características alcalinas. Los 2 enlaces covalentes de la molécula H2O son polares porque el átomo de oxígeno es más electronegativo que el de hidrógeno, por lo que esta molécula tiene un momento dipolar electrostático igual a 6.13x10-30 (coulombs)(angstrom), lo que también indica que la molécula H2O no es lineal, H-O-H.
El agua es un compuesto tan versátil principalmente debido a que el tamaño de su molécula es muy pequeño, a que su molécula es buena donadora de pares de electrones, a que forma puentes de hidrógeno entre sí y con otros compuestos que tengan enlaces como: N-H, O-H y F-H, a que tiene una constante dieléctrica muy grande y a su capacidad para reaccionar con compuestos que forman otros compuestos solubles.
El agua es, quizá el compuesto químico más importante en las actividades del hombre y también más versátil, ya que como reactivo químico funciona como ácido, álcali, ligando, agente oxidante y agente reductor.
Las condiciones medio ambientales en las aguas profundas son muy diferentes según el nivel de profundidad. La temperatura del agua desciende y la presión aumenta a medida que se avanza hacia el fondo. Las posibilidades de alimentarse, que dependen del número y tipo de plantas y animales que existan, varían también mucho con la profundidad. Un animal acuático que sólo puede sobrevivir en profundidades de 6.000 a 7.000 m, no puede cruzar una cordillera del suelo del océano si su cresta se encuentra sólo a 3.000 m por debajo de la superficie.
Suponiendo que exista una relativa uniformidad de temperatura, presión y condiciones alimentarias, los hábitats de agua salada pueden ser divididos en tres zonas: litoral, pelágica y abisal. El litoral incluye las regiones costeras de océanos y mares, desde la orilla del mar hasta una profundidad de aproximadamente 180 m. La población animal incluye una gran cantidad de seres vivos propios de la zona de orilla como corales, mejillones, artrópodos superiores y peces. La zona pelágica comprende la columna de agua del mar abierto de idéntica profundidad que la del litoral. Muchas formas pelágicas, como las medusas y los peces verdaderos equipados con cámaras de aire, están adaptados para flotar, aunque la mayoría de los habitantes de esta zona son capaces de nadar. La zona abisal es el fondo oscuro y profundo del océano. Esta región carece prácticamente de vidavegetal, pero los habitantes abisales, como los cangrejos, se alimentan de organismos muertos que se hunden desde la superficie. En este entorno, las comunidades de plantas y animales que viven en las grietas hidrotermales, donde la cadena alimenticia se basa en bacterias que digieren azufre, son únicas.
El agua subterránea más profunda puede permanecer oculta durante miles o millones de años. No obstante, la mayor parte de los yacimientos están a poca profundidad y desempeñan un papel discreto pero constante dentro del ciclo hidrológico. A nivel global, el agua subterránea representa cerca de un tercio de un uno por ciento del agua de la Tierra, es decir unas 20 veces más que el total de las aguas superficiales de todos los continentes e islas.
El agua subterránea es de esencial importancia para la civilización porque supone la mayor reserva de agua potable en las regiones habitadas por los seres humanos. El agua subterránea puede aparecer en la superficie en forma de manantiales, o puede ser extraída mediante pozos. En tiempos de sequía, puede servir para mantener el flujo de agua superficial, pero incluso cuando no hay escasez, el agua subterránea es preferible porque no tiende a estar contaminada por residuos o microorganismos.
La movilidad del agua subterránea depende del tipo de rocas subterráneas en cada lugar dado. Las capas permeables saturadas capaces de aportar un suministro útil de agua son conocidas como acuíferos. Suelen estar formadas por arenas, gravas, calizas o basaltos. Otras capas, como las arcillas, pizarras, morrenas glaciares y limos tienden a reducir el flujo del agua subterránea. Las rocas impermeables son llamadas acuífugas, o rocas basamentarias. En zonas permeables, la capa superficial del área de saturación de agua se llama nivel freático. Cuando en lugares muy poblados o zonas áridas muy irrigadas se extrae agua del subsuelo demasiado deprisa, el nivel freático puede descender con gran rapidez, haciendo que sea imposible acceder a él, aún recurriendo a pozos muy profundos.
El químico estadounidense Harold Clayton Urey, junto con sus colaboradores, descubrió el deuterio en 1932; consiguió separar el primer isótopo en estado puro de un elemento. Los métodos más eficaces utilizados para separar el deuterio del hidrógeno natural son la destilación fraccionada del agua y el proceso de intercambio catalítico entre agua e hidrógeno. En este último, al combinar agua e hidrógeno en presencia de un catalizador apropiado, se forma deuterio en el agua en una cantidad tres veces superior que en el hidrógeno. El deuterio también se puede concentrar por electrólisis, centrifugación y destilación fraccionada del hidrógeno líquido.
Los glúcidos, carbohidratos, hidratos de carbono o sacáridos (del griego σάκχαρον que significa "azúcar") son moléculas orgánicas compuestas por carbono,hidrógeno y oxígeno. Son solubles en agua y se clasifican de acuerdo a la cantidad de carbonos o por el grupo funcional que tienen adherido. Son la forma biológica primaria de almacenamiento y consumo de energía. Otras biomoléculas energéticas son las grasas y, en menor medida, las proteínas.
El término "hidrato de carbono" o "carbohidrato" es poco apropiado, ya que estas moléculas no son átomos de carbono hidratados, es decir, enlazados a moléculas de agua, sino que constan de átomos de carbono unidos a otros grupos funcionales. Este nombre proviene de la nomenclatura química del siglo XIX, ya que las primeras sustancias aisladas respondían a la fórmula elemental Cn(H2O)n (donde "n" es un entero=1,2,3... según el número de átomos). De aquí el término "carbono-hidratado" se haya mantenido, si bien posteriormente se vio que otras moléculas con las mismas características químicas no se corresponden con esta fórmula. Además, los textos científicos anglosajones aún insisten en denominarlos carbohydrates lo que induce a pensar que este es su nombre correcto. Del mismo modo, en dietética, se usa con más frecuencia la denominación de carbohidratos.
Los glúcidos pueden sufrir reacciones de esterificación, aminación, reducción,oxidación, lo cual otorga a cada una de las estructuras una propiedad especifica, como puede ser de solubilidad.
Carbohidratos o hidratos de carbono: ha habido intentos para sustituir el término de hidratos de carbono. Desde 1996 el Comité Conjunto de la Unión Internacional de Química Pura y Aplicada (International Union of Pure and Applied Chemistry1 ) y de la Unión Internacional de Bioquímica y Biología Molecular (International Union of Biochemistry and Molecular Biology) recomienda el términocarbohidrato y desaconseja el de hidratos de carbono.Sinónimos
Estructura química
Los glúcidos son compuestos formados en su mayor parte por átomos de carbono e hidrógeno y en una menor cantidad de oxígeno. Los glúcidos tienen enlaces químicos difíciles de romper llamados covalentes, mismos que poseen gran cantidad de energía, que es liberada al romperse estos enlaces. Una parte de esta energía es aprovechada por el organismo consumidor, y otra parte es almacenada en el organismo.
En la naturaleza se encuentran en los seres vivos, formando parte de biomoléculas aisladas o asociadas a otras como las proteínas y loslípidos.
Tipos de glúcidos
Los glúcidos se dividen en monosacáridos, disacáridos, oligosacáridos y polisacáridos.
Monosacáridos
Los glúcidos más simples, los monosacáridos, están formados por una sola molécula; no pueden ser hidrolizados a glúcidos más pequeños. La fórmula química general de un monosacárido no modificado es (CH2O)n, donde n es cualquier número igual o mayor a tres, su límite es de 7 carbonos. Los monosacáridos poseen siempre un grupo carbonilo en uno de sus átomos de carbono y grupos hidroxilo en el resto, por lo que pueden considerarse polialcoholes.
Los monosacáridos se clasifican de acuerdo a tres características diferentes: la posición del grupo carbonilo, el número de átomos decarbono que contiene y su quiralidad. Si el grupo carbonilo es un aldehído, el monosacárido es una aldosa; si el grupo carbonilo es unacetona, el monosacárido es una cetosa. Los monosacáridos más pequeños son los que poseen tres átomos de carbono, y son llamadostriosas; aquéllos con cuatro son llamados tetrosas, lo que poseen cinco son llamados pentosas, seis son llamados hexosas y así sucesivamente. Los sistemas de clasificación son frecuentemente combinados; por ejemplo, la glucosa es una aldohexosa (un aldehído de seis átomos de carbono), la ribosa es una aldopentosa (un aldehído de cinco átomos de carbono) y la fructosa es una cetohexosa (una cetona de seis átomos de carbono).
Cada átomo de carbono posee un grupo de hidroxilo (-OH), con la excepción del primero y el último carbono, todos son asimétricos, haciéndolos centros estéricos con dos posibles configuraciones cada uno (el -H y -OH pueden estar a cualquier lado del átomo de carbono). Debido a esta asimetría, cada monosacárido posee un cierto número de isómeros. Por ejemplo la aldohexosa D-glucosa, tienen la fórmula (CH2O)6, de la cual, exceptuando dos de sus seis átomos de carbono, todos son centros quirales, haciendo que la D-glucosa sea uno de los estereoisómeros posibles. En el caso del gliceraldehído, una aldotriosa, existe un par de posibles esteroisómeros, los cuales sonenantiómeros y epímeros (1,3-dihidroxiacetona, la cetosa correspondiente, es una molécula simétrica que no posee centros quirales). La designación D o L es realizada de acuerdo a la orientación del carbono asimétrico más alejados del grupo carbonilo: si el grupo hidroxilo está a la derecha de la molécula es un azúcar D, si está a la izquierda es un azúcar L. Como los D azúcares son los más comunes, usualmente la letra D es omitida.
Ciclación
El grupo aldehído o cetona en una cadena lineal abierta de un monosacárido reaccionará reversiblemente con el grupo hidroxilo sobre un átomo de carbono diferente en la misma molécula para formar un hemiacetal o hemicetal, formando un anillo heterocíclico, con un puente de oxígeno entre los dos átomos de carbono. Los anillos con cinco y seis átomos son llamados formasfuranosa y piranosa respectivamente y existen en equilibrio con la cadena lineal abierta.
Durante la conversión de la forma lineal abierta a la forma cíclica, el átomo de carbono conteniendo el oxígeno carbonilo, llamado el carbono anomérico, se transforma en un centro quiral con dos posibles configuraciones: el átomo de oxígeno puede tomar una posición arriba o abajo del plano del anillo. El par de estereoisómeros resultantes son llamados anómeros. En el α-anómero, el -OH sustituyente sobre el carbono anomérico se encuentra en el lado opuesto del anillo (posición trans) a la cadena CH2OH. La forma alternativa, en la cual el sustituyente CH2OH y el grupo hidroxilo sobre el carbono anomérico están en el mismo lado (posición cis) del plano del anillo, es llamado β-anómero. Como el anillo y la forma abierta se interconvierten, ambos anómeros existen en equilibrio.
Uso en células
Los monosacáridos son la principal fuente de combustible para el metabolismo, siendo usado tanto como una fuente de energía (la glucosa es la más importante en la naturaleza) y en biosíntesis. Cuando los monosacáridos no son necesitados para las células son rápidamente convertidos en otra forma, tales como los polisacáridos. Cuando son metabolizados por la microflora residente oral, conocida comobiopelícula, los mónosacáridos, particularmente la sacarosa es la principal responsable de la caries dental.
Disacáridos
Los disacáridos son glúcidos formados por dos moléculas de monosacáridos y, por tanto, al hidrolizarse producen dos monosacáridos libres. Los dos monosacáridos se unen mediante un enlace covalente conocido como enlace glucosídico, tras una reacción de deshidratación que implica la pérdida de un átomo de hidrógeno de un monosacárido y un grupo hidroxilo del otro monosacárido, con la consecuente formación de una molécula de H2O, de manera que la fórmula de los disacáridos no modificados es C12H22O11.
La sacarosa es el disacárido más abundante y la principal forma en la cual los glúcidos son transportados en las plantas. Está compuesto de una molécula de glucosa y una molécula de fructosa. El nombre sistemático de la sacarosa , O-α-D-glucopiranosil-(1→2)-D-fructofuranosido, indica cuatro cosas:
- Sus monosacáridos: glucosa y fructosa.
- El tipo de sus anillos: glucosa es una piranosa y fructosa es una furanosa.
- Como están ligados juntos: el oxígeno sobre el carbono uno (C1) de α-glucosa está enlazado al C2 de la fructosa.
- El sufijo -osido indica que el carbono anomérico de ambos monosacáridos participan en el enlace glicosídico.
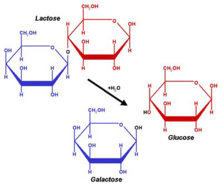
La lactosa, un disacárido compuesto por una molécula de galactosa y una molécula de glucosa, estará presente naturalmente sólo en la leche. El nombre sistemático para la lactosa es O-β-D-galactopiranosil-(1→4)-D-glucopiranosa. Otro disacárido notable incluyen la maltosa(dos glucosa enlazadas α-1,4) y la celobiosa (dos glucosa enlazadas β-1,4).
Oligosacáridos
Los oligosacáridos están compuestos por entre tres y nueve moléculas de monosacáridos que al hidrolizarse se liberan. No obstante, la definición de cuan largo debe ser un glúcido para ser considerado oligo o polisacárido varía según los autores. Según el número de monosacáridos de la cadena se tienen lostrisacáridos (como la rafinosa ), tetrasacárido (estaquiosa), pentasacáridos, etc.
Los oligosacáridos se encuentran con frecuencia unidos a proteínas, formando las glucoproteínas, como una forma común de modificación tras la síntesis proteica. Estas modificaciones post traduccionales incluyen losoligosacáridos de Lewis, responsables por las incompatibilidades de los grupos sanguíneos, el epítope alfa-Gal responsable del rechazo hiperagudo en xenotrasplante y O-GlcNAc modificaciones.
Polisacáridos
Los polisacáridos son cadenas, ramificadas o no, de más de diez monosacáridos. Los polisacáridos representan una clase importante de polímeros biológicos. Su función en los organismos vivos está relacionada usualmente con estructura o almacenamiento. El almidón es usado como una forma de almacenar monosacáridos en las plantas, siendo encontrado en la forma de amilosa y laamilopectina (ramificada). En animales, se usa el glucógeno en vez de almidón el cual es estructuralmente similar pero más densamente ramificado. Las propiedades del glucógeno le permiten ser metabolizado más rápidamente, lo cual se ajusta a la vida activa de los animales con locomoción.
La celulosa y la quitina son ejemplos de polisacáridos estructurales. La celulosa es usada en lapared celular de plantas y otros organismos y es la molécula más abundante sobre la tierra. La quitina tiene una estructura similar a la celulosa, pero tiene nitrógeno en sus ramas incrementando así su fuerza. Se encuentra en los exoesqueletos de los artrópodos y en las paredes celulares de muchos hongos. Tiene diversos de usos, por ejemplo en hilos para sutura quirúrgica. Otros polisacáridos incluyen la callosa, la lamiña, la rina, el xilano y lagalactomanosa.
Los polisacáridos resultan de la condensación de muchas moléculas de monosacáridos con la pérdida de varias moléculas de agua. Su fórmula empírica es: (C6 H10 O5)n.
Función de los glúcidos
Los glúcidos desempeñan diversas funciones, entre las que destacan la energética y la estructural.
Glúcidos energéticos
Los mono y disacáridos, como la glucosa, actúan como combustibles biológico, aportando energía inmediata a las células; es la responsable de mantener la actividad de los músculos, la temperatura corporal, la tensión arterial, el correcto funcionamiento del intestino y la actividad de las neuronas.
Glúcidos estructurales
Algunos polisacáridos forman estructuras esqueléticas muy resistentes, como las celulosa de las paredes de células vegetales y la quitinade la cutícula de los artrópodos.
Otras funciones
La ribosa y la desoxirribosa son constituyentes básicos de los nucleótidos, monómeros del ARN y del ADN.
Los oligosacáridos del glicocáliz tienen un papel fundamental en el reconocimiento celular.
Nutrición
Los glúcidos en una persona de 8,3 y 14,5 g/kg de su peso corporal. Se propone que el 55-60% de la energía diaria que necesita el organismo humano debe provenir de los glúcidos, ya sea obtenidos de alimentos ricos en almidón como las pastas o de las reservas del cuerpo (glucógeno). Se desaconseja, en cambio, el consumo abusivo de glúcidos tipo azúcar por su actividad altamente oxidante (las dietas con muchas calorías o con mucha glucosa aceleran el envejecimiento celular. Se sobreentiende que sí pueden ser necesarias dietas hipercalóricas en climas gélidos o en momentos de gran desgaste energético muscular). Nótese que el sedentarismo o la falta de los suficientes movimientos cotidianos del cuerpo humano provocan una mala metabolización de las grasas y de los glúcidos.
Los glúcidos por su fuerte carácter hidrofílico se rodean de partículas de agua ocupando más espacio en las células pero así son atacados más fácilmente por las enzimas hidrolíticas que las proteínas o las grasas y por eso son la fuente de obtención rápida de energía. Las proteínas y grasas son componentes vitales para la construcción de tejido corporal y células, y por lo tanto debería ser recomendado no malgastar tales recursos usándolos para la producción de energía.
Los glúcidos no son nutrientes esenciales: el cuerpo puede tener toda su energía a partir de las proteínas y grasas. El cerebro no puede quemar grasas y necesita glucosa para energía, del organismo puede sintetizar esta glucosa a partir de proteínas. La metabolización de las proteínas aportan 4 kcal por gramo mientras que las grasas contienen 9 kilocalorías y el alcohol contiene 7 kcal por gramo.
Alimentos con altos contenidos en glúcidos son pastas, patatas, fibra, cereales y legumbres.
Basado en la evidencia del riesgo a la cardiopatía y obesidad, el Instituto de Medicina (Estados Unidos) recomienda que los adultosestadounidenses y canadienses obtengan el 40 al 65% de energía de la dieta a partir de los glúcidos.2 La FAO (Food and Agriculture Organization) y la WHO (World Health Organization) recomiendan que las guías de alimentación nacional establezcan la meta de 55 a 75% del total de la energía a partir de glúcidos, pero sólo 10% de descenso a partir de azúcar libre (glúcidos simples).3
La distinción entre "glúcidos buenos" y "glúcidos malos" es una distinción carente de base científica. Aunque estos conceptos se han usado en el diseño de las dietas cetogénicas como las dietas bajas en glúcidos, las cuales promueven una reducción en el consumo de granos y almidones en favor de proteínas. El resultado es una reducción en los niveles de insulina usada para metabolizar el azúcar y un incremento en el uso de grasas para energía a través de la cetosis, un proceso también conocido como hambre de conejo.
Digestión de los carbohidratos
Si durante la digestión, la degradación de carbohidratos es deficiente a causa de alguna enfermedad intestinal hereditaria, un trastorno intestinal, desnutrición o fármacos que lesionan la mucosa del intestino delgado, el carbohidrato no digerido llega al intestino grueso, donde produce diarrea osmótica. La fermentación bacteriana de los compuestos produce grandes volúmenes de CO2 y H2, lo que ocasiona cólicosabdominales.[cita requerida]
Clasificación
Los nutricionistas y dietistas antiguamente clasificaban los carbohidratos como simples (monosacáridos y disacáridos) o complejos (oligosacáridos y polisacáridos). El término carbohidrato complejo fue usado por primera vez en la publicación Dietary Goals for the United States (1977) del Comité seleccionado del Senado, donde los denominaron "frutas, vegetales y granos enteros".4 Las pautas dietéticas generalmente recomiendan que los carbohidratos complejos y las fuentes de carbohidratos simples ricas en nutrientes, como frutas yproductos lácteos deberían cubrir el grueso del consumo de carbohidratos. Las guías dietéticas para los americanos USDA 2005 prescindieron de la distinción entre simple/complejo, en su lugar recomiendan alimentos integrales y ricos en fibra.5
El índice glicémico y el sistema de la carga de glicemia son populares métodos de clasificación alternativos los cuales clasifican los alimentos ricos en carbohidratos basados en su efecto sobre los niveles de glucosa sanguínea. El índice de insulina es un método de clasificación similar, más reciente el cual clasifica los alimentos basado en su efecto sobre los niveles de insulina. Este sistema asume que los alimentos con índice glicémico alto puede ser declarados para ser la ingesta de alimentos más aceptable.
El informe conjunto de expertos de la WHO y la FAO, en Dieta, Nutrición y Prevención de Enfermedades Crónicas (serie de informes técnicos de la WHO 916), recomienda que el consumo de carbohidratos suponga el 55-75% de la energía diaria, pero restringe el consumo de "azúcar libre" a un 10%.
Aplicaciones
Los carbohidratos se utilizan para fabricar tejidos, películas fotográficas, plásticos y otros productos. La celulosa se puede convertir en rayón de viscosa y productos de papel. El nitrato de celulosa (nitrocelulosa) se utiliza en películas de cine, cemento, pólvora de algodón, celuloidey tipos similares de plásticos. El almidón y la pectina, un agente cuajante, se usan en la preparación de alimentos para el hombre y elganado. La goma arábiga se usa en medicamentos demulcentes. El agar, un componente de algunos laxantes, se utiliza como agente espesante en los alimentos y como medio para el cultivo bacteriano; también en la preparación de materiales adhesivos, de encolado yemulsiones. La hemicelulosa se emplea para modificar el papel durante su fabricación. Los dextranos son polisacáridos utilizados en medicina como expansores de volumen del plasma sanguíneo para contrarrestar las conmociones agudas. Otro hidrato de carbono, el sulfato de heparina, es un anticoagulante de la sangre.
Metabolismo de los glúcidos
Los glúcidos representan las principales moléculas almacenadas como reserva en los vegetales. Los vegetales almacenan grandes cantidades de almidón producido a partir de la glucosa elaborada por fotosíntesis, y en mucha menor proporción, lípidos (aceites vegetales).
Los animales almacenan básicamente triglicéridos (lípidos). Al contrario que los glúcidos, los lípidos sirven para almacenar y obtener energía a más largo plazo. También almacenan cierta cantidad de glucógeno, sobre todo en el músculo y en el hígado. Aunque muchos tejidos yórganos animales pueden usar indistintamente los glúcidos y los lípidos como fuente de energía, otros, principalmente los eritrocitos y eltejido nervioso (cerebro), no pueden catabolizar los lípidos y deben ser continuamente abastecidos con glucosa.
En el tubo digestivo los polisacáridos de la dieta (básicamente almidón) son hidrolizados por las glucosidasas de los jugos digestivos, rindiendo monosacáridos, que son los productos digestivos finales; éstos son absorbidos por las células del epitelio intestinal e ingresan en el hígado a través de la circulación portal, donde, alrededor del 60%, son metabolizados. En el hígado, la glucosa también se puede transformar en lípidos que se transportan posteriormente al tejido adiposo.
El músculo es un tejido en el que la fermentación representa una ruta metabólica muy importante ya que las células musculares pueden vivir durante largos períodos de tiempo en ambientes con baja concentración de oxígeno. Cuando estas células están trabajando activamente, su requerimiento de energía excede su capacidad de continuar con el metabolismo oxidativo de los hidratos de carbono puesto que la velocidad de esta oxidación está limitada por la velocidad a la que el oxígeno puede ser renovado en la sangre. El músculo, al contrario que otros tejidos, produce grandes cantidades de lactato que se vierte en la sangre y retorna al hígado para ser transformado en glucosa.
Por lo tanto las principales rutas metabólicas de los glúcidos son:
En el metabolismo oxidativo encontramos rutas comunes con los lípidos como son el ciclo de Krebs y la cadena respiratoria. Los oligo y polisacáridos son degradados inicialmente a monosacáridos por enzimas llamadas glicósido hidrolasas. Entonces los monosacáridos pueden entrar en las rutas catabólicas de los monosacáridos.
La principal hormona que controla el metabolismo de los hidratos de carbono es la insulina.
Lípido
Los lípidos son un conjunto de moléculas orgánicas, la mayoría biomoléculas, compuestas principalmente por carbono e hidrógeno y en menor medida oxígeno, aunque también pueden contener fósforo, azufre y nitrógeno, que tienen como característica principal el serhidrofóbicas o insolubles en agua y sí en disolventes orgánicos como la bencina, el alcohol, el benceno y el cloroformo. En el uso coloquial, a los lípidos se les llama incorrectamentegrasas, ya que las grasas son sólo un tipo de lípidos procedentes de animales. Los lípidos cumplen funciones diversas en los organismos vivientes, entre ellas la de reserva energética (triglicéridos), la estructural (fosfolípidos de las bicapas) y la reguladora (esteroides).
Los Lípidos también funcionan para el desarrollo de la Materia gris, el metabolismo y el crecimiento.
Los lípidos son biomoléculas muy diversas; unos están formados por cadenas alifáticas saturadas o insaturadas, en general lineales, pero algunos tienen anillos (aromáticos). Algunos son flexibles, mientras que otros son rígidos o semiflexibles hasta alcanzar casi una totalflexibilidad molecular; algunos comparten carbonos libres y otros forman puentes de hidrógeno.[editar]Características generales
La mayoría de los lípidos tiene algún tipo de carácter polar, además de poseer una gran parte apolar o hidrofóbico ("que le teme al agua" o "rechaza al agua"), lo que significa que no interactúa bien con solventes polares como el agua. Otra parte de su estructura es polar ohidrofílica ("que ama el agua" o "que tiene afinidad por el agua") y tenderá a asociarse con solventes polares como el agua; cuando una molécula tiene una región hidrófoba y otra hidrófila se dice que tiene carácter anfipático. La región hidrófoba de los lípidos es la que presenta solo átomos de carbono unidos a átomos de hidrógeno, como la larga "cola" alifática de los ácidos grasos o los anillos de esterano delcolesterol; la región hidrófila es la que posee grupos polares o con cargas eléctricas, como el hidroxilo (–OH) del colesterol, el carboxilo (–COO–) de los ácidos grasos, el fosfato (–PO4–) de los fosfolípidos, etc.
[editar]Clasificación biológica
Los lípidos son un grupo muy heterogéneo que usualmente se clasifican en dos grupos, atendiendo a que posean en su composición ácidos grasos (lípidos saponificables) o no lo posean (lípidos insaponificables).
Lípidos saponificables
- Simples. Lípidos que sólo contienen carbono, hidrógeno y oxígeno.
- Acilglicéridos. Cuando son sólidos se les llama grasas y cuando son líquidos a temperatura ambiente se llaman aceites.
- Céridos (ceras)
- Complejos. Son los lípidos que además de contener en su molécula carbono, hidrógeno y oxígeno, también contienen otros elementoscomo nitrógeno, fósforo, azufre u otra biomolécula como un glúcido. A los lípidos complejos también se les llama lípidos de membrana pues son las principales moléculas que forman las membranas celulares.
- Fosfolípidos
- Fosfoglicéridos
- Fosfoesfingolípidos
- Glucolípidos
- Cerebrósidos
- Gangliósidos
Lípidos insaponificables
- Terpenoides
- Esteroides
- Eicosanoides
[editar]Lípidos saponificables
[editar]Ácidos grasos

Estructura 3D del ácido linoleico, un tipo de ácido graso. En rojo se observa la cabeza polar correspondiente a un grupo
carboxilo.
Son las unidades básicas de los lípidos saponificables, y consisten en moléculas formadas por una larga cadena hidrocarbonada con un número par de átomos de carbono (12-24) y un grupo carboxiloterminal. La presencia de dobles enlaces en el ácido graso reduce el punto de fusión. Los ácidos grasos se dividen en saturados e insaturados.
- Saturados. Sin dobles enlaces entre átomos de carbono; por ejemplo, ácido láurico, ácido mirístico, ácido palmítico, acido margárico, ácido esteárico, ácido araquídico y ácido lignogérico.
- Insaturados. Los ácidos grasos insaturados se caracterizan por poseer dobles enlaces en su configuración molecular. Éstas son fácilmente identificables, ya que estos dobles enlaces hacen que su punto de fusión sea menor que en el resto. Se presentan ante nosotros como líquidos, como aquellos que llamamos aceites. Este tipo de alimentos disminuyen el colesterol en sangre y también son llamados ácidos grasos esenciales. Los animales no son capaces de sintetizarlos, pero los necesitan para desarrollar ciertas funciones fisiológicas, por lo que deben aportarlos en la dieta. La mejor forma y la más sencilla para poder enriquecer nuestra dieta con estos alimentos, es aumentar su ingestión, es decir, aumentar su proporción respecto los alimentos que consumimos de forma habitual.Con uno o más dobles enlaces entre átomos de carbono; por ejemplo, ácido palmitoleico, ácido oleico, ácido elaídico, ácido linoleico, ácido linolénico yácido araquidónico y acido nervónico.
Los denominados ácidos grasos esenciales no pueden ser sintetizados por el organismo humano y son el ácido linoleico, el ácido linolénico y el ácido araquidónico, que deben ingerirse en la dieta.
[editar]Propiedades físicoquímicas
- Carácter Anfipático. Ya que el ácido graso esta formado por un grupo carboxilo y una cadena hidrocarbonada, esta última es la que posee la característica hidrófoba; siendo responsable de su insolubilidad en agua.
- Punto de fusión: Depende de la longitud de la cadena y de su número de insaturaciones, siendo los ácidos grasos insaturados los que requieren menor energía para fundirse.
- Esterificación. Los ácidos grasos pueden formar ésteres con grupos alcohol de otras moléculas
- Saponificación. Por hidrólisis alcalina los ésteres formados anteriormente dan lugar a jabones (sal del ácido graso)
- Autooxidación. Los ácidos grasos insaturados pueden oxidarse espontáneamente, dando como resultado aldehídos donde existían los dobles enlaces covalentes.
[editar]Acilglicéridos

Representación tridimensional de un triglicérido.
Los acilglicéridos o acilgliceroles son ésteres de ácidos grasos con glicerol (glicerina), formados mediante una reacción de condensación llamada esterificación. Una molécula de glicerol puede reaccionar con hasta tres moléculas de ácidos grasos, puesto que tiene tres grupos hidroxilo.
Según el número de ácidos grasos que se unan a la molécula de glicerina, existen tres tipos de acilgliceroles:
- Monoglicéridos. Sólo existe un ácido graso unido a la molécula de glicerina.
- Diacilglicéridos. La molécula de glicerina se une a dos ácidos grasos.
- Triacilglicéridos. Llamados comúnmente triglicéridos, puesto que la glicerina está unida a tres ácidos grasos; son los más importantes y extendidos de los tres.
Los triglicéridos constituyen la principal reserva energética de los animales, en los que constituyen las grasas; en los vegetales constituyen los aceites. El exceso de lípidos es almacenado en grandes depósitos en el tejido adiposo de los animales.
Las ceras son moléculas que se obtienen por esterificación de un ácido graso con un alcohol monovalente lineal de cadena larga. Por ejemplo la cera de abeja. Son sustancias altamente insolubles en medios acuosos y a temperatura ambiente se presentan sólidas y duras. En los animales las podemos encontrar en la superficie del cuerpo, piel, plumas, cutícula, etc. En los vegetales, las ceras recubren en laepidermis de frutos, tallos, junto con la cutícula o la suberina, que evitan la pérdida de agua por evaporación.
[editar]Fosfolípidos
Los fosfolípidos se caracterizan por poseer un grupo fosfato que les otorga una marcada polaridad. Se clasifican en dos grupos, según posean glicerol o esfingosina.
[editar]Fosfoglicéridos
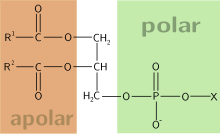
Estructura de un fosfoglicérido; X representa el alcohol o aminoalcohol que se esterifica con el grupo fosfato; el resto representa el ácido fosfatídico.
Los fosfoglicéridos están compuestos por ácido fosfatídico, una molécula compleja compuesta por glicerol, al que se unen dos ácidos grasos (uno saturado y otro insaturado) y un grupo fosfato; el grupo fosfato posee un alcohol o un aminoalcohol, y el conjunto posee una marcada polaridad y forma lo que se denomina la "cabeza" polar del fosfoglicérido; los dos ácidos grasos forman las dos "colas" hidrófobas; por tanto, los fosfoglicéridos son moléculas con un fuerte carácteranfipático que les permite formar bicapas, que son la arquitectura básica de todas las membranas biológicas.
Los principales alcoholes y aminoalcoholes de los fosfoglicéridos que se encuentran en lasmembranas biológicas son la colina (para formar la fosfatidilcolina o lecitina), la etanolamina(fosfatidiletanolamina o cefalina), serina (fosfatidilserina) y el inositol (fosfatidilinositol).
[editar]Fosfoesfingolípidos
Los fosfoesfingolípidos son esfingolípidos con un grupo fosfato, tienen una arquitectura molecular y unas propiedades similares a los fosfoglicéridos. No obstante, no contienen glicerol, sinoesfingosina, un aminoalcohol de cadena larga al que se unen un ácido graso, conjunto conocido con el nombre de ceramida; a dicho conjunto se le une un grupo fosfato y a éste un aminoalcohol; el más abundante es la esfingomielina, en la que el ácido graso es el ácido lignocérico y el aminoalcohol la colina; es el componente principal de la vaina de mielina que recubre los axonesde las neuronas.
[editar]Glucolípidos
Los glucolípidos son esfingolípidos formados por una ceramida (esfingosina + ácido graso) unida a un glúcido, careciendo, por tanto, de grupo fosfato. Al igual que los fosfoesfingolípidos poseen ceramida, pero a diferencia de ellos, no tienen fosfato ni alcohol. Se hallan en las bicapas lipídicas de todas las membranas celulares, y son especialmente abundantes en el tejido nervioso; el nombre de los dos tipos principales de glucolípidos alude a este hecho:
Los glucolípidos se localizan en la cara externa de la bicapa de las membranas celulares donde actúan de receptores.
[editar]Lípidos insaponificables
Los terpenos, terpenoides o isoprenoides, son lípidos derivados del hidrocarburo isopreno (o 2-metil-1,3-butadieno). Los terpenos biológicos constan, como mínimo de dos moléculas de isopreno. Algunos terpenos importantes son los aceites esenciales (mentol, limoneno,geraniol), el fitol (que forma parte de la molécula de clorofila), las vitaminas A, K y E, los carotenoides (que son pigmentos fotosintéticos) y elcaucho (que se obtiene del árbol Hevea brasiliensis).Desde el punto de vista farmacéutico, los grupos de principios activos de naturaleza terpénica más interesantes son: monoterpenos y sesquiterpenos constituyentes de los aceites esenciales, derivados de monoterpenos correspondientes a los iridoides, lactonas sesquiterpénicas que forman parte de los principios amargos, algunos diterpenos que poseen actividades farmacológicas de aplicación a la terapéutica y por último, triterpenos y esteroides entre los que se encuentran las saponinas y los heterósidos cardiotónicos.
Los esteroides son lípidos derivados del núcleo del hidrocarburo esterano (ociclopentanoperhidrofenantreno), esto es, se componen de cuatro anillos fusionados de carbono que posee diversos grupos funcionales (carbonilo, hidroxilo) por lo que la molécula tiene partes hidrofílicas e hidrofóbicas (carácter anfipático).
Entre los esteroides más destacados se encuentran los ácidos biliares, las hormonas sexuales, las corticosteroides, la vitamina D y el colesterol. El colesterol es el precursor de numerosos esteroides y es un componente más de la bicapa de las membranas celulares.Esteroides Anabólicos es la forma como se conoce a las substancias sintéticas basadas en hormonas sexuales masculinas (andrógenos). Estas hormonas promueven el crecimiento de músculos (efecto anabólico) así como también en desarrollo de las características sexuales masculinas (efecto andrógeno).
Los esteroides anabólicos fueron desarrollados a finales de 1930 principalmente para tratar el Hipogonadismo, una condición en la cual los testículos no producen suficiente testosterona para garantizar un crecimiento, desarrollo y función sexual normal del individuo. Precisamente a finales de 1930 los científicos también descubrieron que estos esteroides facilitaban el crecimiento de músculos en los animales de laboratorio, lo cual llevo al uso de estas sustancias por parte de físicos culturistas y levantadores de pesas y después por atletas de otras especialidades.
El abuso de los esteroides se ha diseminado tanto que hoy en día afecta el resultado de los eventos deportivos.
[editar]Eicosanoides
Los eicosanoides o icosanoides son lípidos derivados de los ácidos grasos esenciales de 20 carbonos tipo omega-3 y omega-6. Los principales precursores de los eicosanoides son el ácido araquidónico, el ácido linoleico y el ácido linolénico. Todos los eicosanoides son moléculas de 20 átomos de carbono y pueden clasificarse en tres tipos: prostaglandinas, tromboxanos y leucotrienos.
Cumplen amplias funciones como mediadores para el sistema nervioso central, los procesos de la inflamación y de la respuesta inmunetanto de vertebrados como invertebrados. Constituyen las moléculas involucradas en las redes de comunicación celular más complejas delorganismo animal, incluyendo el hombre.
[editar]Funciones de los lípidos
Los lípidos desempeñan diferentes tipos de funciones biológicas:
[editar]Importancia para los organismos vivientes
Las vitaminas A, D, E y K son liposolubles, lo que significa que estas solo pueden ser digeridas, absorbidas y transportadas en conjunto con las grasas. Las grasas son fuentes de ácidos grasos esenciales, un requerimiento dietario importante. Las grasas juegan un papel vital en el mantenimiento de una piel y cabellos saludables, en el aislamiento de los órganos corporales contra el shock, en el mantenimiento de la temperatura corporal y promoviendo la función celular saludable. Estos además sirven como reserva energética para el organismo. Las grasas son degradadas en el organismo para liberar glicerol y ácidos grasos libres. El glicerol puede ser convertido por el hígado y entonces ser usado como fuente energética.
El contenido de grasas de los alimentos puede ser analizado por extracción. El método exacto varía según el tipo de grasa a ser analizada, por ejemplo, las grasas poliinsaturadas y monoinsaturadas son analizadas de forma muy diferente.
Las grasas también sirven como un buffer muy útil hacia una gran cantidad de enfermedades. Cuando una sustancia particular sea química o biotica, alcanza niveles no seguros en el torrente sanguíneo, el organismo puede efectivamente diluir (o al menos mantener un equilibrio) las sustancias dañinas almacenándolas en nuevo tejido adiposo. Esto ayuda a proteger órganos vitales, hasta que la sustancia dañina pueda ser metabolizada y/o retirada de la sangre a través de la excreción, orina, sangramiento accidental o intencional, excreción de cebo y crecimiento del pelo.
Aunque es prácticamente imposible remover las grasas completamente de la dieta, sería equivocado hacerlo. Algunos ácidos grasos son nutrientes esenciales, significando esto que ellos no pueden ser producidos en el organismo a partir de otros componentes y por lo tanto necesitan ser consumidos en pequeñas cantidades. Todas las otras grasas requeridas por el organismo no son esenciales y pueden ser producidas en el organismo a partir de otros componentes.
[editar]Tejido adiposo
El tejido adiposo o graso es el medio utilizado por el organismo humano para almacenar energía a lo largo de extensos períodos de tiempo. Dependiendo de las condiciones fisiológicas actuales, los adipocitos almacenan triglicéridos derivadas de la dieta y el metabolismo hepáticoo degrada las grasas almacenadas para proveer ácidos grasos y glicerol a la circulación. Estas actividades metabólicas son reguladas por varias hormonas (insulina, glucagón y epinefrina). La localización del tejido determina su perfil metabólico: la grasa visceral está localizada dentro de la pared abdominal (debajo de los músculos de la pared abdominal) mientras que la grasa subcutánea está localizada debajo de lapiel (incluye la grasa que está localizada en el área abdominal debajo de la piel pero por encima de los músculos de la pared abdominal). Durante un tiempo se pensó que la grasa visceral producía una hormona involucrada en la resistencia a la insulina, pero esto ha sido desechado por las pruebas clínicas.
Proteína
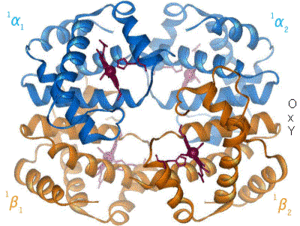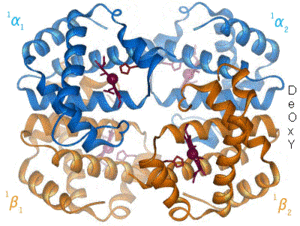
Estructura tridimensional de la
hemoglobina. La animación corresponde a la transición conformacional entre las formas oxigenada y desoxigenada.
Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos. El nombre proteína proviene de la palabra griega πρώτα ("prota"), que significa "lo primero" o del dios Proteo, por la cantidad de formas que pueden tomar.
Las proteínas desempeñan un papel fundamental para la vida y son lasbiomoléculas más versátiles y más diversas. Son imprescindibles para el crecimiento del organismo. Realizan una enorme cantidad de funciones diferentes, entre las que destacan:
Las proteínas están formadas por aminoácidos.
Las proteínas de todos los seres vivos están determinadas mayoritariamente por sugenética (con excepción de algunos péptidos antimicrobianos de síntesis no ribosomal), es decir, la información genética determina en gran medida qué proteínas tiene una célula, un tejido y un organismo.
Las proteínas se sintetizan dependiendo de cómo se encuentren regulados los genes que las codifican. Por lo tanto, son susceptibles a señales o factores externos. El conjunto de las proteínas expresadas en una circunstancia determinada es denominado proteoma.
Características
Los prótidos o proteínas son biopolímeros, es decir, están constituidas por gran número de unidades estructurales simples repetitivas (monómeros). Debido a su gran tamaño, cuando estas moléculas se dispersan en un disolvente adecuado, forman siempre dispersiones coloidales, con características que las diferencian de las disoluciones de moléculas más pequeñas.
Por hidrólisis, las moléculas de proteína se escinden en numerosos compuestos relativamente simples, de masa molecular pequeña, que son las unidades fundamentales constituyentes de la macromolécula. Estas unidades son los aminoácidos, de los cuales existen veinteespecies diferentes y que se unen entre sí mediante enlaces peptídicos. Cientos y miles de estos aminoácidos pueden participar en la formación de la gran molécula polimérica de una proteína.
Todas las proteínas tienen carbono, hidrógeno, oxígeno y nitrógeno y casi todas poseen también azufre. Si bien hay ligeras variaciones en diferentes proteínas, el contenido de nitrógeno representa, por término medio, 16% de la masa total de la molécula; es decir, cada 6,25 g de proteína contienen 1 g de N. El factor 6,25 se utiliza para estimar la cantidad de proteína existente en una muestra a partir de la medición de N de la misma.
La síntesis proteica es un proceso complejo cumplido por las células según las directrices de la información suministrada por los genes.
Las proteínas son largas cadenas de aminoácidos unidas por enlaces peptídicos entre el grupo carboxilo (-COOH) y el grupo amino (-NH2) de residuos de aminoácido adyacentes. La secuencia de aminoácidos en una proteína está codificada en su gen (una porción de ADN) mediante el código genético. Aunque este código genético especifica los 20 aminoácidos "estándar" más la selenocisteína y —en ciertosArchaea— la pirrolisina, los residuos en una proteína sufren a veces modificaciones químicas en la modificación postraduccional: antes de que la proteína sea funcional en la célula, o como parte de mecanismos de control. Las proteínas también pueden trabajar juntas para cumplir una función particular, a menudo asociándose para formar complejos proteicos estables.
Las proteínas ocupan un lugar de máxima importancia entre las moléculas constituyentes de los seres vivos (biomoléculas). Prácticamente todos los procesos biológicos dependen de la presencia o la actividad de este tipo de moléculas. Bastan algunos ejemplos para dar idea de la variedad y trascendencia de las funciones que desempeñan. Son proteínas:
Es la manera como se organiza una proteína para adquirir cierta forma. Presentan una disposición característica en condiciones fisiológicas, pero si se cambian estas condiciones como temperatura, pH, etc. pierde la conformación y su función, proceso denominado desnaturalización. La función depende de la conformación y ésta viene determinada por lasecuencia de aminoácidos.
Para el estudio de la estructura es frecuente considerar una división en cuatro niveles de organización, aunque el cuarto no siempre está presente.
Conformaciones o niveles estructurales de la disposición tridimensional:
A partir del nivel de dominio sólo las hay globulares.
[editar]Propiedades de las proteínas
- Solubilidad: Se mantiene siempre y cuando los enlaces fuertes y débiles estén presentes. Si se aumenta la temperatura y el pH, se pierde la solubilidad.
- Capacidad electrolítica: Se determina a través de la electroforesis, técnica analítica en la cual si las proteínas se trasladan al polo positivo es porque su molécula tiene carga negativa y viceversa.
- Especificidad: Cada proteína tiene una función específica que está determinada por su estructura primaria.
- Amortiguador de pH (conocido como efecto tampón): Actúan como amortiguadores de pH debido a su carácter anfótero, es decir, pueden comportarse como ácidos (aceptando electrones) o como bases (donando electrones).
[editar]Desnaturalización
Si en una disolución de proteínas se producen cambios de pH, alteraciones en la concentración, agitación molecular o variaciones bruscas de temperatura, la solubilidad de las proteínas puede verse reducida hasta el punto de producirse su precipitación. Esto se debe a que los enlaces que mantienen la conformación globular se rompen y la proteína adopta la conformación filamentosa. De este modo, la capa de moléculas de agua no recubre completamente a las moléculas proteicas, las cuales tienden a unirse entre sí dando lugar a grandes partículas que precipitan. Además, sus propiedades biocatalizadores desaparecen al alterarse el centro activo. Las proteínas que se hallan en ese estado no pueden llevar a cabo la actividad para la que fueron diseñadas, en resumen, no son funcionales.
Esta variación de la conformación se denomina desnaturalización. La desnaturalización no afecta a los enlaces peptídicos: al volver a las condiciones normales, puede darse el caso de que la proteína recupere la conformación primitiva, lo que se denomina renaturalización.
Ejemplos de desnaturalización son la leche cortada como consecuencia de la desnaturalización de la caseína, la precipitación de la clara de huevo al desnaturalizarse la ovoalbúmina por efecto del calor o la fijación de un peinado del cabello por efecto de calor sobre las queratinasdel pelo.1
[editar]Reacciones de reconocimiento
El reactivo de Biuret está formado por una disolución de sulfato de cobre en medio alcalino, este reconoce el enlace peptídico de las proteínas mediante la formación de un complejo de coordinación entre los iones Cu2+ y los pares de electrones no compartidos del nitrógenoque forma parte de los enlaces peptídicos, lo que produce una coloración rojo-violeta.
Se pone de manifiesto por la formación de un precipitado negruzco de sulfuro de plomo. Se basa esta reacción en la separación mediante un álcali, del azufre de los aminoácidos, el cual al reaccionar con una solución de acetato de plomo, forma el sulfuro de plomo.
Reconoce residuos fenólicos, o sea aquellas proteínas que contengan tirosina. Las proteínas se precipitan por acción de los ácidos inorgánicos fuertes del reactivo, dando un precipitado blanco que se vuelve gradualmente rojo al calentar.
Reconoce grupos aromáticos, o sea aquellas proteínas que contengan tirosina o fenilalanina, con las cuales el ácido nítrico forma compuestos nitrados amarillos.
[editar]Determinación de la estabilidad proteica
La estabilidad de una proteína es una medida de la energía que diferencia al estado nativo de otros estados "no nativos" o desnaturalizados. Hablaremos de estabilidad termodinámica cuando podamos hacer la diferencia de energía entre el estado nativo y el desnaturalizado, para lo cual se requiere reversibilidad en el proceso de desnaturalización. Y hablaremos de estabilidad cinética cuando, dado que la proteína desnaturaliza irreversiblemente, sólo podemos diferenciar energéticamente la proteína nativa del estado de transición (el estado limitante en el proceso de desnaturalización) que da lugar al estado final. En el caso de las proteínas reversibles, también se puede hablar de estabilidad cinética, puesto que el proceso de desnaturalización también presenta un estado limitante. Actualmente se ha demostrado que algunas proteínas reversibles pueden carecer de dicho estado limitante, si bien es un tema aún controvertido en la bibliografía científica.
La determinación de la estabilidad proteica puede realizarse con diversas técnicas. La única de ellas que mide directamente los parámetros energéticos es la calorimetría (normalmente en la modalidad de calorimetría diferencial de barrido). En esta se mide la cantidad de calor que absorbe una disolución de proteína cuando es calentada, de modo que al aumentar la temperatura se produce una transición entre el estado nativo y el estado desnaturalizado que lleva asociada la absorción de una gran cantidad de calor.
El resto de técnicas miden propiedades de las proteínas que son distintas en el estado nativo y en el estado desplegado. Entre ellas se podrían citar la fluorescencia de triptófanos y tirosinas, el dicroísmo circular, radio hidrodinámico, espectroscopia infrarroja, resonancia magnética nuclear, etc. Una vez hemos elegido la propiedad que vamos a medir para seguir la desnaturalización de la proteína, podemos distinguir dos modalidades: Aquellas que usan como agente desnaturalizante el incremento de temperatura y aquellas que hacen uso de agentes químicos (como urea, cloruro de guanidinio, tiocianato de guanidinio, alcoholes, etc.). Estas últimas relacionan la concentración del agente utilizado con la energía necesaria para la desnaturalización. Una de las últimas técnicas que han emergido en el estudio de las proteínas es la microscopía de fuerza atómica. Esta técnica es cualitativamente distinta de las demás, puesto que no trabaja con sistemas macroscópicos sino con moléculas individuales. Mide la estabilidad de la proteína a través del trabajo necesario para desnaturalizarla cuando se aplica una fuerza por un extremo mientras se mantiene el otro extremo fijo a una superficie.
La importancia del estudio de la estabilidad proteica está en sus implicaciones biomédicas y biotecnológicas. Así, enfermedades como elAlzheimer o el Parkinson están relacionadas con la formación de amiloides (polímeros de proteínas desnaturalizadas). El tratamiento eficaz de estas enfermedades podría encontrarse en el desarrollo de fármacos que desestabilizaran las formas amiloidogénicas o bien que estabilizaran las formas nativas. Por otro lado, cada vez más proteínas van siendo utilizadas como fármacos. Resulta obvio que los fármacos deben presentar una estabilidad que les dé un alto tiempo de vida cuando están almacenados y un tiempo de vida limitado cuando están realizando su acción en el cuerpo humano.
En cuanto a la importancia en las aplicaciones biotecnológicas radica en que pese a su extrema eficacia catalítica su baja estabilidad dificulta su uso (muchas proteínas de potencial interés apenas mantienen su configuración nativa y funcional por unas horas).
[editar]Clasificación
[editar]Según su forma
- Fibrosas: presentan cadenas polipeptídicas largas y una estructura secundaria atípica. Son insolubles en agua y en disoluciones acuosas. Algunos ejemplos de éstas son queratina, colágeno y fibrina.
- Globulares: se caracterizan por doblar sus cadenas en una forma esférica apretada o compacta dejando grupos hidrófobos hacia adentro de la proteína y grupos hidrófilos hacia afuera, lo que hace que sean solubles en disolventes polares como el agua. La mayoría de las enzimas, anticuerpos, algunas hormonas y proteínas de transporte, son ejemplos de proteínas globulares.
- Mixtas: posee una parte fibrilar (comúnmente en el centro de la proteína) y otra parte globular (en los extremos).
[editar]Según su composición química
- Simples: su hidrólisis sólo produce aminoácidos. Ejemplos de estas son la insulina y el colágeno (globulares y fibrosas).
- Conjugadas o heteroproteínas: su hidrólisis produce aminoácidos y otras sustancias no proteicas llamadas grupo prostético.
[editar]Fuentes de proteínas
Las fuentes dietéticas de proteínas incluyen carne, huevos, soja, granos, legumbres y productos lácteos tales como queso o yogurt. Las fuentes animales de proteínas poseen los 20 aminoácidos. Las fuentes vegetales son deficientes en aminoácidos y se dice que sus proteínas son incompletas. Por ejemplo, la mayoría de las legumbres típicamente carecen de cuatro aminoácidos incluyendo el aminoácido esencial metionina, mientras los granos carecen de dos, tres o cuatro aminoácidos incluyendo el aminoácido esencial lisina. Sin embargo, para aquellas personas que tienen una dieta vegetariana, existe la opción de complementar la ingesta de proteínas de productos vegetales con diferentes tipos de aminoácidos para contrarrestar la falta de algún aminoácido componente.
[editar]Calidad proteica
Las diferentes proteínas tienen diferentes niveles de familia biológica para el cuerpo humano. Muchos alimentos han sido introducidos para medir la tasa de utilización y retención de proteínas en humanos. Éstos incluyen valor biológico, NPU (Net Protein Utilization) y PDCAAS (Protein Digestibility Corrected Amino Acids Score), la cual fue desarrollado por la FDA mejorando el PER (Protein Efficiency Ratio). Estos métodos examinan qué proteínas son más eficientemente usadas por el organismo. En general, éstos concluyeron que las proteínas animales que contienen todos los aminoácidos esenciales (leche, huevos, carne) y la proteína de soya son las más valiosas para el organismo.
[editar]Deficiencia de proteínas
Deficiencia de proteínas en el tercer mundo La deficiencia de proteína es una causa importante de enfermedad y muerte en el tercer mundo. La deficiencia de proteína juega una parte en la enfermedad conocida como kwashiorkor. La guerra, la hambruna, la sobrepoblacióny otros factores incrementaron la tasa de malnutrición y deficiencia de proteínas. La deficiencia de proteína puede conducir a una inteligenciareducida o retardo mental. La malnutrición proteico calórica afecta a 500 millones de personas y más de 10 millones anualmente. En casos severos el número de células blancas disminuye, de la misma manera se ve reducida drásticamente la habilidad de los leucocitos de combatir una infección.
Deficiencia de proteínas en países desarrollados La deficiencia de proteínas es rara en países desarrollados pero un pequeño número de personas tiene dificultad para obtener suficiente proteína debido a la pobreza. La deficiencia de proteína también puede ocurrir en países desarrollados en personas que están haciendo dieta para perder peso, o en adultos mayores quienes pueden tener una dieta pobre. Las personas convalecientes, recuperándose de cirugía, trauma o enfermedades pueden tener déficit proteico si no incrementan su consumo para soportar el incremento en sus necesidades. Una deficiencia también puede ocurrir si la proteína consumida por una persona está incompleta y falla en proveer todos los aminoácidos esenciales.
[editar]Exceso de consumo de proteínas
Como el organismo es incapaz de almacenar las proteínas, el exceso de proteínas es digerido y convertido en azúcares o ácidos grasos. El hígado retira el nitrógeno de los aminoácidos, una manera de que éstos pueden ser consumidos como combustible, y el nitrógeno es incorporado en la urea, la sustancia que es excretada por los riñones. Estos órganos normalmente pueden lidiar con cualquier sobrecarga adicional pero si existe enfermedad renal, una disminución en la proteína frecuentemente será prescrita.
El exceso en el consumo de proteínas también puede causar la pérdida de calcio corporal, lo cual puede conducir a pérdida de masa ósea a largo plazo. Sin embargo, varios suplementos proteicos vienen suplementados con diferentes cantidades de calcio por ración, de manera que pueden contrarrestar el efecto de la pérdida de calcio.
Algunos sospechan que el consumo excesivo de proteínas está ligado a varios problemas:
- Hiperreactividad del sistema inmune.
- Disfunción hepática debido a incremento de residuos tóxicos.
- Pérdida de densidad ósea, la fragilidad de los huesos es debido a que el calcio y la glutamina son filtrados de los huesos y el tejido muscular para balancear el incremento en la ingesta de ácidos a partir de la dieta. Este efecto no esta presente si el consumo de minerales alcalinos (a partir de frutas y vegetales, los cereales son ácidos como las proteínas, las grasas son neutras) es alto.
En tales casos, el consumo de proteínas es anabólico para el hueso. Muchos investigadores piensan que un consumo excesivo de proteínas produce un incremento forzado en la excreción del calcio. Si hay consumo excesivo de proteínas, se piensa que un consumo regular de calcio seré capaz de estabilizar, o inclusive incrementar la captación de calcio por el intestino delgado, lo cual sería más beneficioso a las mujeres mayores.[1]
Las proteínas son frecuentemente causa de alergias y reacciones alérgicas a ciertos alimentos. Esto ocurre porque la estructura de cada forma de proteína es ligeramente diferente, algunas pueden desencadenar una respuesta a partir del sistema inmune mientras otros permanecen perfectamente seguros. Muchas personas son alérgicas a la caseína, la proteína en la leche; al gluten, la proteína en el trigo y otros granos; a la proteína particular encontrada en el maní; o aquellas encontradas en mariscos y otras comidas marinas. Es extremadamente inusual que una misma persona reaccione adversamente a más de dos tipos diferentes de proteínas, debido a la diversidad entre tipos de proteínas o aminoácidos. Aparte de eso las proteínas ayudan a la formación de la masa muscular, para todas aquellas personas que le gusta hacer ejercicio, en lo cual se recomienda la pechuga de pollo salcochado debido al alto indice de proteína que esta trae y no se esta consumiendo la grasa.[3]
[editar]Análisis de proteínas en alimentos
El clásico ensayo para medir concentración de proteínas en alimentos es el método de Kjeldahl. Este ensayo determina el nitrógeno total en una muestra.
El único componente de la mayoría de los alimentos que contiene nitrógeno son las proteínas (las grasas, los carbohidratos y la fibra dietética no contienen nitrógeno). Si la cantidad de nitrógeno es multiplicada por un factor dependiente del tipo de proteína esperada en el alimento, la cantidad total de proteínas puede ser determinada. En las etiquetas de los alimentos, la proteína es expresada como el nitrógeno multiplicado por 6,25, porque el contenido de nitrógeno promedio de las proteínas es de aproximadamente 16%. El método de Kjeldahl es usado porque es el método que la AOAC International ha adoptado y por lo tanto es usado por varias agencias alimentarias alrededor del mundo.
[editar]Digestión de proteínas
La digestión de las proteínas se inicia típicamente en el estómago cuando el pepsinógeno es convertido a pepsina por la acción del ácido clorhídrico, y continúa por la acción de la tripsina y la quimotripsina en el intestino. Las proteínas de la dieta son degradadas a péptidoscada vez más pequeños y éstos hasta aminoácidos y sus derivados, que son absorbidos por el epitelio gastrointestinal. La tasa de absorción de los aminoácidos individuales es altamente dependiente de la fuente de proteínas; por ejemplo la digeribilidad de muchos aminoácidos en humanos difiere entre la proteína de la soja y la proteína de la leche2 y entre proteínas de la leche individuales, como beta-lactoglobulina y caseína.3 Para las proteínas de la leche, aproximadamente el 50% de la proteína ingerida se absorbe en el estómago o el yeyuno y el 90% se ha absorbido ya cuando los alimentos ingeridos alcanzan el íleon.4
Además de su rol en la síntesis de proteínas, los aminoácidos también son una importante fuente nutricional de nitrógeno. Las proteínas, al igual que los carbohidratos, contienen 4 kilocalorías por gramo, mientras que los lípidos contienen 9 kcal y los alcoholes 7 kcal. Los aminoacidos pueden ser convertidos en glucosa a través de un proceso llamado gluconeogénesis.
Ácidos nucleicos
De acuerdo a la composición química, los ácidos nucleicos se clasifican en ácidos desoxiribonucleicos (ADN) que se encuentran residiendo en el núcleo celular y algunos organelos, y en ácidos ribonucleicos (ARN) que actúan en el citoplasma. Se conoce con considerable detalle la estructura y función de los dos tipos de ácidos.
Estructura. El conocimiento de la estructura de los ácidos nucleicos permitió la elucidación del código genético, la determinación del mecanismo y control de la síntesis de las proteínas y el mecanismo de transmisión de la información genética de la célula madre a las células hijas.
A las unidades químicas que se unen para formar los ácidos nucleicos se les denomina nucleótidos y al polímero se le denominapolinucleótido o ácido nucleico.
Los nucleótidos están formados por una base nitrogenada, un grupo fosfato y un azúcar; ribosa en caso de ARN y desoxiribosa en el caso de ADN.
Las bases nitrogenadas son las que contienen la información genética y los azúcares y los fosfatos tienen una función estructural formando el esqueleto del polinucleótido.
En el caso del ADN las bases son dos purinas y dos pirimidinas. Las purinas son A (Adenina) y G (Guanina). Las pirimidinas son T (Timina) y C (Citosina) . En el caso del ARN también son cuatro bases, dos purinas y dos pirimidinas. Las purinas son A y G y las pirimidinas son C y U (Uracilo).

Figura 1.1.1.D.-Estructura de las Bases Nitrogenadas.
Las bases se unen al carbono 1' del azúcar y el fosfato en el carbón 5' para formar el nucleótido.

Figura 1.1.1.E.-Estructura de un Nucleótido.
Los nucleótidos se unen para formar el polinucleótido por uniones fosfodiester entre el carbono 5' de un nucleótido y el carbono 3' del siguiente.

Figura 1.1.1.F.-Unión Fosfodiester en los Ácidos Nucleicos.
Un dinucleótido en el que se unieron un nucleótido con la base A con un nucleótido con la base G y el enlace fosfodiester se formó entre el carbono 3'del nucleótido con base A y el 5'del nucleótido con base G, se representa simplemente como AG. Si a este dinucleótido se le agrega otro nucleótido en el carbono 3' y este nucleótido tiene una base T, el trinucleótido resultante se representará por AGT. Ésta es la forma simplificada en que se acostumbra representar los polinucleótidos.
El ADN está formado por dos cadenas muy largas de polinucleótidos unidas entre sí por puentes de hidrógeno específicos entre las bases de las dos cadenas. La base de una cadena que se une por los puentes de hidrógeno con la base de la otra cadena se dice que forman un par de bases. A se parea con T y G con C (Figura 1.1.1.G.).
Las dos cadenas se encuentran arregladas en una estructura helicoidal alrededor de un eje común por lo que recibe el nombre de doble hélice. Las bases se encuentran acomodadas hacia el eje de la doble hélice, mientras que el azúcar y los fosfatos se encuentran orientados hacia el exterior de la molécula.

Figura 1.1.1.G.-Estructura de los Pares de Bases.
El dimensiones de la hélice, independientemente de la especie, son las siguientes: diámetro 20 Angstrom y la longitud del paso 34 Angstrom el cual está constituido por 10 residuos de nucleótidos. El tamaño de la molécula de ADN de doble hélice se expresa en miles de bases o kb. La longitud de 1kb es entonces 0.34 micras.
Una molécula de ADN de un milímetro de longitud estará formado de 3 mil kb o sea tres millones de bases.
Así pues la molécula de ADN es un largo filamento de 20 Angstrom de diámetro cuya longitud depende del número de kb, el cual a su vez depende de la especie. El rango de tamaño va desde 2 micras (5 kb) en el virus SV40, hasta casi un metro (3 x 106 kb) en cromosomas humanos. El genoma de E. coli, no tiene extremos, o sea forma un círculo, y el perímetro tiene una longitud de 1.4 mm (4000kb). El genoma de los animales superiores no forma círculos, es una estructura lineal abierta.

Figura 1.1.1.H.- Estructura de la Doble Hélice
En los cromosomas estas moléculas se arreglan en estructuras más compactas en las que la doble hélice se enrolla sobre sí misma. En el caso de las bacterias, la molécula de ADN de más de un milímetro de longitud se arregla dentro de la bacteria que sólo tiene una longitud de una micra (o sea es una longitud mil veces menor).
El ARN es un filamento de una sola cadena, no forma doble hélice. La presencia de un oxígeno en la posición 2' de la ribosa impide que se forme la doble cadena de la manera en que se forma en el ADN. El filamento de ARN se puede enrollar sobre sí mismo mediante la formación de pares de bases en algunas secciones de la molécula.
Existen varios tipos de ARN cada uno con función distinta. Los que forman parte de las subunidades de los ribosomas se les denominaARN ribosomal (rARN), los ARN que tienen la función de transportar los aminoácidos activados, desde el citosol hasta el lugar de síntesis de proteínas en los ribosomas; se les conoce por ARN de transferencia (tARN) y los ARN que son portadores de la información genética y la transportan del genoma (molécula de ADN en el cromosoma) a los ribosomas son llamados ARN mensajero (mARN). El tamaño de las moléculas de ARN es mucho menor que las del ADN. En el caso de E. coli va de menos de 100 nucleótidos en los tARN hasta casi 4000 (4kb) en rARN.
Información genética. La estructura de la doble hélice para el ADN fue originalmente propuesta por Watson y Crick (WyC) en 1953, postulando que la secuencia en la cual se encuentran las bases a lo largo de la molécula de ADN es lo que contiene la información genética. No existe ningún impedimento estérico que limite la secuencia de bases, cualquier base puede seguir a cualquier otra.
Transmisión.- Con estas bases, WyC propusieron el mecanismo de duplicación del ADN por medio del cual, las dos células hijas provenientes de una división celular contienen copias idénticas del ADN presente en la célula que se dividió. A la duplicación del ADN se le conoce con el nombre de replicación.
Durante la replicación, las dos cadenas se van separando y cada una de ellas sirve de patrón para la síntesis de su cadena complementaria. Las bases se van agregando una a una y la selección de cuál base entra en un sitio específico de la cadena en formación, queda determinada por la base en la cadena patrón con la que se va a aparear.
Donde hay una A en la cadena patrón, se inserta una T en la cadena en proceso de formación y, donde hay una T se inserta una A, y lo mismo sucede con el apareamiento de G y C. La nueva cadena tiene una secuencia de bases complementaria a la cadena original.
El modelo de duplicación del ADN se dice que es semi-conservado, porque la mitad del ADN de un cromosoma, una cadena completa, proviene de la célula paterna y la otra mitad, la otra cadena, se sintetiza durante el proceso de replicación.
Este es el mecanismo propuesto por Watson y Crick para explicar la transmisión de la información genética de una generación a otra.
La formación de las uniones fosfodiester está catalizada por la ADN polimerasa. La ADN polimerasa no formará la unión fosfodiester, a menos que la base que está entrando a la molécula, sea complementaria a la base existente en la cadena patrón. La frecuencia con la que se inserta una base equivocada es menor a 1 en 100 millones.
Flujo. El apareamiento de bases es también el mecanismo para enviar la información genética desde el núcleo hasta los ribosomas y dirigir la síntesis de proteínas. En este caso una porción de una de las cadenas del ADN sirve de patrón para la síntesis de ARN y la secuencia de bases en el ARN es complementaria a la que se presenta en la porción de la cadena que se está copiando.
Al ARN que se sintetiza en esta forma se le denomina ARN mensajero o mARN. La síntesis del ARN es catalizada por la ARN polimerasa, que al igual que la ADN polimerasa es una enzima patrón-dependiente.
El mARN se une, en el citoplasma, a las dos subunidades ribosomales, constituyendo el ribosoma activo, que es la estructura celular responsable de la síntesis de proteínas. Es en este organelo donde el mARN especifica la secuencia en que deben de insertarse los aminoácidos en la síntesis de polipéptidos. Ésta es la forma en que la información contenida en los cromosomas se traduce en la especificación de la estructura primaria de las proteínas. Como ya se mencionó, la estructura primaria determina la estructura tridimensional de la proteína, la que a su vez determina su funcionalidad.
Al proceso de copiado de la información genética contenida en el ADN cromosomal durante la síntesis del mARN se le llamatranscripción. Al proceso de lectura, en el ribosoma, de la información transportada por mARN, durante la síntesis de proteína, se le conoce como traducción.

Figura 1.1.1.I.- Mecanismo de replicación, transcripción y traducción
La porción de ADN que contiene la información para codificar una proteína determinada se le da el nombre de gene y normalmente recibe el mismo nombre de la proteína que codifica, usando casi siempre, una abreviación de tres letras. A la porción de ADN que codifica un conjunto de proteínas que entran en un paso del metabolismo se le llama operón. Por ejemplo; al conjunto de genes que intervienen en la codificación de las proteínas que intervienen en la utilización de lactosa se les llama lac operón.
El lenguaje utilizado para describir el proceso de dirección de la síntesis de proteínas por los genes del cromosoma refleja la interpretación de que se trata de un flujo de información.
Tabla 1.1.1. A.- El Código Genético
| | U | C | A | G | |
| U | Phe
Phe
Leu
Leu | Ser
Ser
Ser
Ser | Tyr
Tyr
Alto
Alto | Cys
Cys
Alto
Trp | U
C
A
G |
| C | Leu
Leu
Leu
Leu | Pro
Pro
Pro
Pro | His
His
Gln
Gln | Arg
Arg
Arg
Arg | U
C
A
G |
| A | Ile
Ile
Ile
Met
(Inicio) | Thr
Thr
Thr
Thr | Asn
Asn
Lys
Lys | Ser
Ser
Arg
Arg | U
C
A
G |
| G | Val
Val
Val
Val | Ala
Ala
Ala
Ala | Asp
Asp
Glu
Glu | Gly
Gly
Gly
Gly | U
C
A
G |
Primera
Posición
(5'-) | Segunda Posición | Tercera
Posición
(3'-) |
El mensaje que está contenido en el genoma se encuentra escrito en un lenguaje de 4 letras (las cuatro bases), el cual se transcribe usando el mismo lenguaje, al sintetizar el mARN. La síntesis de proteínas se le denomina traducción porque ahora se pasa del lenguaje de 4 letras a otro con 20 letras (los 20 aminoácidos). Para pasar de un lenguaje a otro se necesita un código para hacer la traducción y se le denomina código genético.
Las equivalencias entre los dos lenguajes se presentaron en la tabla anterior. Tres bases contiguas (un triplete) codifican un aminoácido, así como también para la puntuación del mensaje. Se determinó qué tripletes codifican cada aminoácido y qué tripletes indican el inicio y la terminación del mensaje. Al triplete se le dio el nombre de codón. Se encontró que algunos aminoácidos podían ser codificados por más de un codón, o sea hay codones que son sinónimos. Por esta razón se dijo que el código genético es degenerado.
Modificaciones. Al estudio de las bases moleculares de la herencia se le conoce como genética molecular o biología molecular y a las modificaciones artificiales del ADN con el fin de cambiar el mensaje genético que contiene se le conoce como ingeniería genética.
Se pueden agregar porciones de ADN que contienen genes que no están presentes en el cromosoma incrementando el número de genes de la célula, o bien se pueden inducir cambios que eliminen genes activos presentes en la célula haciendo en este caso que la célula pierda cierta capacidad genética.
Cuando se modifica la molécula de ADN de un organismo agregándole porciones de ADN provenientes de otro organismo se dice que se hizo una recombinación del ADN y al resultado se le llama ADN recombinante. Esta técnica se usa para producir organismos capaces de hacer funciones que el organismo original no tenía. Por ejemplo se puede introducir en una bacteria el gene de la insulina humana y la bacteria adquirirá la capacidad de sintetizar ese polipéptido.
Tabla 1.1.1.B- Mutaciones del ADN.
Tipo de mutación | Secuencia del ADN | Secuencia del
polipéptido Cadena
superior |
| Ninguna | AAT CGG GAG
TTA GCC CTC | Asn Arg Val |
Transversión
(GC:TA) | AAT CCG TAG
TTA GCC ATC | Asn Arg (fin) |
| Transición GC:AT | AAT ACC AAG
TTA GCC TTC | Asn Arg Lis |
Incerción, cambio de marco
Produce la sig. secuencia | AXA TCG GGA
T T AGC CCT
ATA TCG CCT
TAT AGC CCT |
Ileu Ser Gli |
En párrafos anteriores se mencionó que la replicación del ADN se hace con gran fidelidad, con una frecuencia de errores del orden de 10-8, sin embargo, sí ocurren errores.
Si se substituye una purina por otra, o una pirimidina por otra, al cambio se le llama transición; si se substituye una purina por una pirimidina al cambio se le llama transversión; si se agrega o elimina una base entonces se produce lo que se llama un cambio de marco. En este último caso, se lee en forma errónea todo el mensaje que sigue al punto de cambio. En algunas ocasiones, cuando se modifica una de las bases y la ADN polimerasa no la identifica, entonces introduce una A y el cambio final será la introducción de una T en la cadena patrónLa célula tiene mecanismos para eliminar los errores o cambios que ocurren en el ADN, bien sea durante la síntesis o cuando ya está formado. Si la célula no repara los cambios y entra en el proceso de duplicación con el ADN modificado, el cambio se fija y se vuelve permanente. El gene modificado puede ahora codificar una proteína diferente, y si este es el caso, se dice que tuvo lugar una mutación. En la Tabla 1.1.1.B se presenta el efecto de los cambios en el ADN sobre la estructura primaria del polipéptido que codifica.
Existen varias substancias que incrementan significativamente la frecuencia con la que ocurren cambios en las bases que se introducen en el ADN que se está sintetizando y se les denomina mutágenos. La mayoría de los cancerígenos son mutágenos.
Tabla1.1.1.C- Mutágenos y su Efecto sobre el ADN.
Mutágeno | Mecanismo | Resultado en el ADN |
Agentes alquilantes
(nitrosourea,nitrosoguanidina) | Se une covalentemente y
forma sitios apurínicos | Transición y transversión |
Agentes desaminantes
(ácido nitroso) | Adenina-hipoxantina
y citosina-uracilo | Transición |
Base análoga
(2-aminopurina) | Substitución durante
la replicación del ADN | Transición |
Agente intercalante
(antridinas, antraciclinas) | Inserción o eliminación de
pares de bases | Cambio de cuadro |
Fraccionadores de las cadenas
(radiaciones ionisantes) | Translocación cromosomal | Cambio de una o más bases |
Si la substitución, inserción o eliminación de una base tuvo lugar en alguna parte del ADN que codifica una proteína, entonces puede cambiar un codón y dar lugar a una modificación que produzca la introducción de un aminoácido diferente o se codifique por terminación de la cadena peptídica.
Las mutaciones se clasifican de acuerdo al efecto que tienen sobre el producto del gene modificado. Se dice que la mutación es: 1) sin sentido, si el producto es inactivo o incompleto, 2) de pérdida del sentido, si el producto es defectuoso y 3) silenciosa, si no se altera ni la función ni la cantidad del producto activo.