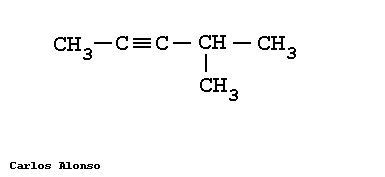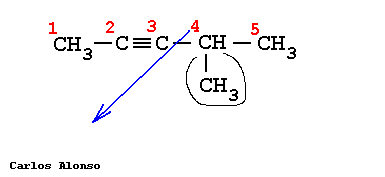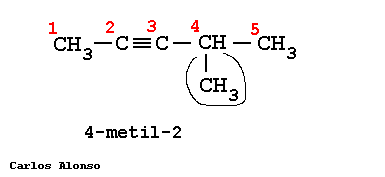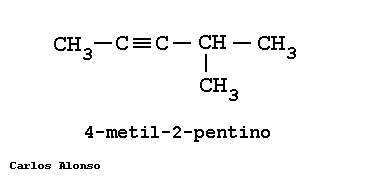Los hidrocarburos son sustancias que contienen en su estructura carbono e hidrógeno. Su nomenclatura depende de la cantidad de carbono presente en las cadenas y del tipo de enlace mediante el cual se unen entre ellos; este enlace puede ser simple, doble o triple. Así tenemos alcanos, alquenos y alquinos que constituyen cadenas normales o ramificadas, alicíclicas o cíclicas. Asimismo, se pueden
INTRODUCCIÓN
Este trabajo recoge el producto de muchas horas de esfuerzo en la enseñanza de los
En este trabajo se resume brevemente la manera cómo se nombran los diferentes hidrocarburos en función a las recomendaciones de la IUPAC; no pretende ser un tratado de Química Orgánica, sino sólo una
A) HIDROCARBUROS LINEALES
I.- El átomo de carbono en los compuestos orgánicos presenta siempre cuatro electrones libres para compartir, es

II.- Los átomos de carbono se pueden unir a otros átomos de carbono formando cadenas. Frecuentemente, pueden formarse cadenas hasta de cien carbonos porque cadenas mayores se debilitan y se rompen, aunque pueden hallarse algunas superiores a este número.
III.- Las cadenas carbonadas, también pueden incluir átomos diferentes, como por ejemplo oxígeno, nitrógeno, azufre y otros:
CH3—O—CH2—CH3 CH3—NH—CH3
IV.- Para nombrar a los hidrocarburos se utilizan prefijos que indican el número de carbonos y dependiendo del tipo de enlace que presenten se usan sufijos tales como:
Alcanos: terminación "ano" ( Sólo enlaces simples)
Alquenos: terminación "eno"( Por lo menos un enlace doble)
Alquinos: terminación "ino " ( Por lo menos un enlace triple)
Los prefijos a utilizar, aparecen en la siguiente tabla, de acuerdo al número de átomos de carbono:
Nº | PREFIJO | Nº | PREFIJO | Nº | PREFIJO |
01 | META | 20 | ICOSA | 60 | HEXACONTA |
02 | ETA | 21 | HENICOSA | 61 | HENHEXACONTA |
03 | PROPA | 22 | DOCOSA | 65 | PENTAHEXACONTA |
04 | BUTA | 30 | TRIACONTA | 70 | HEPTACONTA |
05 | PENTA | 31 | HENTRIACONTA | 71 | HENHEPTACONTA |
06 | HEXA | 32 | DOTRIACONTA | 76 | HEXAHEPTACONTA |
07 | HEPTA | 40 | TETRACONTA | 80 | OCTACONTA |
08 | OCTA | 41 | HENTETRACONTA | 83 | TRIOCTACONTA |
09 | NONA | 43 | TRITETRACONTA | 86 | HEXAOCTACONTA |
10 | DECA | 50 | PENTACONTA | 90 | NONACONTA |
11 | UNDECA | 51 | HENPENTACONTA | 91 | HENNONACONTA |
12 | DODECA | 54 | TETRAPENTACONTA | 100 | HECTANO |
NOTA: Los cuatro primeros prefijos son arbitrarios y los demás en su mayoría son griegos.
El prefijo pierde la "A"

| Primario | Un carbono es primario si está unido sólo a un átomo de carbono. | 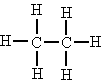 Los dos átomos de carbono son primarios |
| Secundario | Si está unido a dos átomos de carbono. | 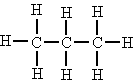 El átomo de carbono central es secundario. |
| Terciario | Si está unido a tres átomos de carbono. | 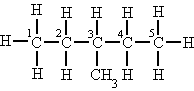 El átomo de carbono (3) es terciario. |
| Cuaternario | Si está unido a cuatro átomos de carbono. | 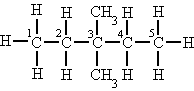 El átomo de carbono (3) es cuaternario. |
Los cicloalcanos o alcanos cíclicos son hidrocarburos saturados, cuyo esqueleto es formado únicamente por átomos de carbono unidos entre ellos con enlaces simples en forma de anillo. Su fórmula genérica es CnH2n. Por fórmula son isómeros de los alquenos. También existen compuestos que contienen varios anillos, los compuestos policíclicos.
Se nombran del mismo modo que los hidrocarburos de cadena abierta de igual número de carbonos ante poniendo el prefijo ciclo.
[editar]Nomenclatura
Se nombran del mismo modo que los hidrocarburos de cadena abierta de igual número de carbonos ante poniendo el prefijo ciclo.
En los ciclo alcanos con cadena laterales se debe nombrar de la siguiente forma - El nombre de la cadena o radical que las forma en primer lugar se existe una ramificación se nombra sucesivamente los radicales con indicación de su posición correspondiente
Resultan más sencillos nombrarlos como derivados de un cicloalcano que no como derivados de un compuesto de cadena abierta
Estos compuestos es mejor nombrar como derivados de un alcano de cadena abierta
Se da nombre a los sustituyentes del anillo- grupos alquilo, alógenos y sus posiciones se señalan con números. Asignamos la posición 1 a un carbono en particular y luego numeramos alrededor del anillo en el sentido de las manecillas del reloj o en el contrario, hacemos todo esto de modo que resulte la combinación de números más bajos
[editar]Propiedades físicas
Tienen características especiales debidas a la tensión del anillo. Esta tensión es a su vez de dos tipos:
- Tensión de anillo torsional o de solapamiento.
- Tensión de ángulo de enlace o angular.
El ángulo de los orbitales sp3 se desvía del orden de los 109º a ángulos inferiores. Es especialmente inestable el ciclopropano cuya reactividad es similar a la de los alquenos.
[editar]Propiedades químicas
Su reactividad (con excepción de los anillos muy pequeños: ciclopropano, ciclobutano y ciclopentano) es casi equivalente a la de los compuestos de cadena abierta.
[editar]Presencia
Los cicloalcanos aparecen de forma natural en diversos petróleos. Los terpenos, a que pertenecen una gran cantidad de hormonas como elestrógeno, el colesterol, la progesterona o la testosterona y otras como el alcanfor, suelen presentar un esqueleto policíclico.
Monociclos con anillos mayores (14 - 18 átomos de carbono) están presentes en las segregaciones de las glándulas del Almizcle utilizado en perfumería.
En la Industria Petrolera se usan para poder extraer hidrocarburos, según la compañia de petróleos Camilo Guerrero Occidental Company, el uso de cicloalcanos en su extracción petrolifera es debido a la densidad de este componente y su cadena cerrada los hacen mas maneables que alguno de cadena abierta, a su vez el cicloalcano mas usado en la extracción petrolifera es la de el ciclopentano.
[editar]Algunos cicloalcanos
[ed]
Ciclopropano
itar
]
]
Ciclopropano
El cicloalcano más simple, formado por tres átomos de carbono, es el ciclopropano. Se genera por la Reacción de Wurtz intramolecular a partir de 1,3-dibromopropano con sodio o zinc. Se trata de una sustancia muy inestable y reactiva debido a la elevada tensión del anillo.
Todos sus enlaces se encuentran en posición ecplipsada. Los ángulos de enlace se desvian desde los 109º a los 60º. El esqueleto de la molécula es un triángulo, por tanto la molécula es plana.
Su reactividad es parecida a la de los alquenos. En particular, son típicas las reacciones de adición con los halógenos (p. ej. con Cl2, Br2,...) que conllevan la apertura del anillo, y por tanto, están favorecidas por la disminución de la tensión angular en el seno de la molécula.
Sus derivados se encuentran en algunas sustancias biológicamente activas. Se generan convenientemente a partir del alqueno correspondiente mediante adición de un carbono.
1A) ACÍCLICOS
Salvo los 4 primeros, que reciben el nombre de metano, etano, propano y butano, los demás se nombran mediante un prefijo
griego que indica el número de carbonos, y la terminación -ano.
Cuando el hidrocarburo es ramificado, el radical se nombra cambiando la terminación -ano por -ilo
ELECCIÓN DE LA CADENA PRINCIPAL
Para nombrarlos, la. cadena más larga se, numera de un extremo a otro, (le tal forma que se asignen los números más bajos a los
carbonos con cadenas laterales, independientemente de la naturaleza de los sustituyentes.
Cuando hay varias cadenas de igual longitud, se elige como principal:
La que tenga mayor numero de cadenas laterales
La que tenga las cadenas laterales con los localizadores más bajos
La que tenga el máximo número de carbonos en las cadenas laterales más pequeñas.
La que tenga cadenas laterales lo menos ramificadas posible
Un radical alquilo (antes llamado radical libre alquilo) es una entidad molecular inestable derivado de un alcanoque ha perdido un átomo de hidrógeno y ha quedado con un electrón desapareado o impar, siendo por ello muy inestable.1 El radical formado está centrado sobre el átomo de carbono, es decir, el electrón desapareado está localizado sobre dicho átomo,por poseer mayor densidad de espín.2 El electrón desapareado se muestra como un punto en los diagramas o fórmulas estructurales.
Si dicho grupo de átomos se encuentra dentro de una molécula mayor y no está formalmente separado de ella, se llama grupo alquilo.
Los alquenos u olefinas son hidrocarburos insaturados que tienen uno o varios dobles enlaces carbono-carbonoen su molécula. Se puede decir que un alqueno no es más que un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre decicloalquenos.
Contenido[ocultar] |
[editar]Producción de alquenos
Aunque muchos se obtienen a partir del petróleo, por destilación industrial en refinerías, también es muy importante la producción de olefinasa nivel industrial.
[editar]Formulación y nomenclatura de alquenos
La fórmula general de un alqueno de cadena abierta con un sólo doble enlace es CnH2n. Por cada doble enlace adicional habrá dos átomos de hidrógeno menos de los indicados en dicha fórmula.
[editar]Nombres tradicionales
Al igual que ocurre con otros compuestos orgánicos, algunos alquenos se conocen todavía por sus nombres no sistemáticos, en cuyo caso se sustituye la terminación -eno sistemática por -ileno, como es el caso del eteno que en ocasiones se llama etileno, o propeno porpropileno.
[editar]Nomenclatura sistemática (IUPAC)
1. Nombrar al hidrocarburo principal: Se ha de encontrar la cadena carbonada más larga que contenga el enlace doble, no necesariamente la de mayor tamaño, colocando los localizadores que tengan el menor número en los enlaces dobles, numerando los átomos de carbono en la cadena comenzando en el extremo más cercano al enlace doble. NOTA: Si al enumerar de izquierda a derecha como de derecha a izquierda, los localizadores de las insaturaciones son iguales, se busca que los dobles enlaces tenga menor posición o localizador más bajo.
2. Si la cadena principal tiene sustituyentes iguales en el mismo átomo de carbono separando por comas los números localizadores que se repiten en el átomo, estos se separan por un guión de los prefijos: Di, Tri, Tetra, etc. Respectivamente al número de veces que se repita el sustituyente.
3. Los sustituyentes se escriben de acuerdo al orden alfabético con su respectivo localizador.
4. Si en la cadena principal existen varios sustituyentes ramificados iguales se coloca el número localizador en la cadena principal separando por un guión, y se escribe el prefijo correspondiente al número de veces que se repita con los prefijos: Bis, Tris, Tetraquis, Pentaquis, etc. Seguido de un paréntesis dentro de cual se nombra al sustituyente complejo con la terminación -IL
5. Realizado todo lo anterior con relación a los sustituyentes, se coloca el número de localizador del doble enlace en la cadena principal separada de un guión, seguido del nombre de acuerdo al número de átomos de carbono reemplazando la terminación -ano por el sufijo -eno.
6. Si se presentan más de un enlace doble, se nombra indicando la posición de cada uno de los dobles enlaces con su respectivo número localizador, se escribe la raíz del nombre del alqueno del cual proviene, seguido de un prefijo de cantidad: di, tri, tetra, etc. y utilizando el sufijo -eno. Ej:-dieno, -trieno y así sucesivamente.
| Fórmula | Recomendaciones IUPAC-1979 | Recomendaciones IUPAC-19931 2 |
|---|---|---|
| localizador - prefijo de número átomos C (acabado en -eno) | prefijo de número átomos C - localizador -eno | |
| CH3-CH2-CH=CH2 | 1-buteno | but-1-eno |
[editar]Estructura electrónica del enlace doble C=C
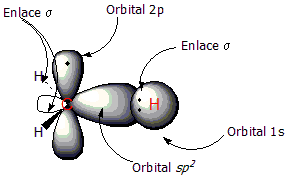
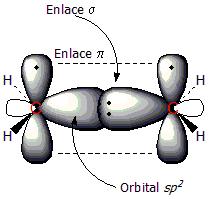
Utilizaremos el eteno como ejemplo de compuesto con doble enlace C=C. El doble enlace tiene dos componentes: el enlace tipo σ y el enlace tipo π. Los dos átomos de carbono que comparten el enlace tienen una hibridación sp2, hibridación resultante de la mezcla de unorbital 2s y dos orbitales 2p, lo cual conduce a la formación de tres orbitales sp2 de geometría trigonal plana. Al combinarse estos orbitalessp2 los electrones compartidos forman un enlace σ, situado entre ambos carbonos.
En la primera figura puede observarse el radical metilo, con un orbital sp2 que enlaza a un átomo de hidrógeno al carbono. En la segunda figura se aprecia la formación del enlace π (línea de puntos); que se forma mediante el solapamiento de los dos orbitales 2pperpendiculares al plano de la molécula. En este tipo de enlace los electrones están deslocalizados alrededor de los carbonos, por encima y por debajo del plano molecular.
[editar]Energía de enlace
Energéticamente, el doble enlace se forma mediante la edición de dos tipos de enlace, el σ y el π. La energía de dichos enlaces se obtiene a partir del cálculo del solapamiento de los dos orbitales constituyentes, y en este caso el solapamiento de los orbitales sp2 es mucho mayor que los orbitales p (el primero crea el enlace σ y el segundo el π) y por tanto la componente σ es bastante más energética que la π. La razón de ello es que la densidad de los electrones en el enlace π están más alejados del núcleo del átomo. Sin embargo, a pesar de que el enlace π es más débil que el σ, la combinación de ambos hace que un doble enlace sea más fuerte que un enlace simple.
El que el doble enlace sea rígido (en contraposición al enlace simple, formado por un solo enlace σ, que puede rotar libremente a lo largo de su eje) se debe a la presencia de los orbitales π, así, para que exista una rotación, es necesario romper los enlaces π y volver a formarlos. La energía necesaria para romper estos enlaces no es demasiado elevada, del orden de los 65 kcal·mol-1, lo cual corresponde a temperaturas de entre 400 y 500 °C. Esto significa que por debajo de estas temperaturas los dobles enlaces permanecen rígidos y, por lo tanto, la molécula es configuracionalmente estable, pero por encima el enlace π puede romperse y volverse a formar y aparece una rotación libre.
[editar]Síntesis
Los alquenos se pueden sintetizar de una de cuatro reacciones:
- Deshidrohalogenación
- CH3CH2Br + KOH → CH2=CH2 + H2O + KBr
- Deshidratación
- La eliminación de agua a partir de alcoholes, por ejemplo:
- CH3CH2OH + H2SO4 → CH3CH2OSO3H + H2O → H2C=CH2 + H2SO4 + H2O
- También por la reacción de Chugaev y la reacción de Grieco.
- Deshalogenación
- BrCH2CH2Br + Zn → CH2=CH2 + ZnBr2
- Pirólisis (con calor)
- CH3(CH2)4 → CH2=CH2 + CH3CH2CH2CH3
[editar]Propiedades físicas
La presencia del doble enlace modifica ligeramente las propiedades físicas de los alquenos frente a los alcanos. De ellas, la temperatura de ebullición es la que menos se modifica. La presencia del doble enlace se nota más en aspectos como la polaridad y la acidez.
[editar]Polaridad
Dependiendo de la estructura, puede aparecer un momento dipolar débil. El enlace alquilo-alquenilo está polarizado en la dirección del átomo con orbital sp2, ya que la componente s de un orbital sp2 es mayor que en un sp3 (esto podría interpretarse como la proporción de s a p en la molécula, siendo 1:2 en sp2 y 1:3 en sp3, aunque dicha idea es simplemente intuitiva). Esto es debido a que los electrones situados en orbitales híbridos con mayor componente s están más ligados al núcleo que los p, por tanto el orbital sp2 es ligeramente atrayente de electrones y aparece una polarización neta hacia él. Una vez que tenemos polaridad en el enlace neta, la geometría de la molécula debe permitir que aparezca un momento dipolar neto en la molécula, como se aprecia en la figura inferior. 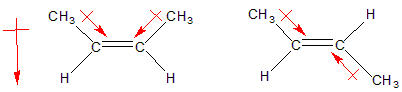
'La primera molécula' es cis y tenemos un momento dipolar neto, pero la segunda trans, pese a tener dos enlaces ligeramente polarizados el momento dipolar neto es nulo al anularse ambos momentos dipolares.
[editar]Acidez
El carbono alquenílico tiene mayor acidez frente a los alcanos, debido también a la polaridad del enlace. Así, el etano (alcano) tiene un pKade 50 (ó un Ka de 10-50) frente al pKa = 44 del eteno. Este hecho se explica fácilmente considerando que, al desprenderse un electrón de la molécula, queda una carga negativa remanente que en el caso del eteno se deslocaliza más fácilmente en el enlace π y σ que en el enlace σ simple que existe en un alcano. De todas formas, su acidez es menor que la de los alcoholes o los ácidos carboxílicos.
[editar]Reacciones
Los alquenos son más reactivos que los alcanos. Sus reacciones características son las de adición de otras moléculas, como haluros de hidrógeno, hidrógeno y halógenos. También sufren reacciones de polimerización, muy importantes industrialmente.
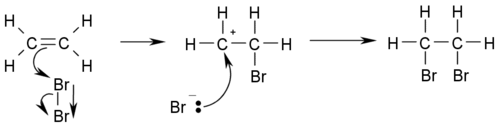
- Hidrohalogenación: se refiere a la reacción con haluros de hidrógeno formando alcanos halogenados del modo CH3CH2=CH2 + HX → CH3CHXCH3. Por ejemplo, halogenación con el ácido HBr:

Estas reacciones deben seguir la Regla de Markownikoff de enlaces dobles.
- Hidrogenación: se refiere a la hidrogenación catalítica (usando Pt, Pd, o Ni) formando alcanos del modo CH2=CH2 + H2 → CH3CH3.
- Halogenación: se refiere a la reacción con halógenos (representados por la X) del modo CH2=CH2 + X2 → XCH2CH2X. Por ejemplo, halogenación con bromo:
- Polimerización: Forman polímeros del modo n CH2=CH2 → (-CH2-CH2-)n polímero, (polietileno en este caso).
Son hidrocarburos de cadena abierta que se caracterizan por tener uno o más triples enlaces, Carbono-Carbono. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
En general su nomenclatura sigue las pautas indicadas para los alquenos, pero terminando en "-ino". Más interesante es la nomenclatura de los hidrocarburos que contienen dobles y triples enlaces en su molécula.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Busca la cadena más larga que contenga todos los triples enlaces, en este caso es de 5 carbonos. Numera los carbonos comenzando por el extremo que tenga más cerca una insaturación, es decir, un triple enlace. Marca los radicales y fíjate a qué carbonos están unidos. Nombra los localizadores seguidos de los nombres de los radicales por orden alfabético. Por último, nombra la cadena principal con el prefijo correspondiente y terminada en -ino. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Escribe la cadena más larga de carbonos, en este caso 5 carbonos. Sitúa los triples enlaces en los carbonos que nos indican los localizadores, el 1 y 4. Sitúa los radicales sobre la cadena con la ayuda de los localizadores. Completa el esqueleto de carbonos con hidrógenos hasta completar los cuatro enlaces de cada carbono. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hidrocarburos aromáticos Cuando se estudian las reacciones de algunos compuestos insaturados, cuyo ejemplo más típico es el benceno y sus derivados, se observan características marcadamente distintas de las de los compuestos alifáticos, por lo que se agrupan en una nueva serie llamada aromática, término que, en un principio, provenía del hecho de que muchos compuestos de esta serie tenían olores intensos y casi siempre agradables. El hidrocarburo aromático más sencillo es el benceno, que constituye, además, el compuesto fundamental de toda la serie aromática. La estructura molecular del benceno ha sido estudiada exhaustivamente por numerosos métodos tanto químicos como físicos. El benceno (y los demás anillos aromáticos) no puede representarse por una sola fórmula, sino por varias llamadas estructuras resonantes o mesómeras, que son ficticias, pero cuya superposición imaginaria es capaz de dar cuenta de las propiedades características del benceno, así como de otros compuestos con resonancia. Modernamente, para no tener que escribir todas las estructuras resonantes, se representa el benceno por la siguiente fórmula estructural simplificada:
Los hidrocarburos aromáticos más sencillos pueden considerarse como derivados del benceno, por sustitución de uno o varios átomos de hidrógeno por radicales hidrocarbonados, bien sean saturados, como metilo, etilo, n-propilo, iso-propilo, etc., o no saturados, como etenilo o vinilo, etinilo, etc. Existen, además, muchos otros hidrocarburos aromáticos con varios anillos, llamados, por esto, polinucleares, como por ejemplo el naftaleno, antraceno, fenantreno, etcétera, y todos sus derivados por sustitución de átomos de hidrógeno por radicales hidrocarbonados. Nomenclatura de los hidrocarburos aromáticos Para nombrar los hidrocarburos derivados del benceno por alquilación tales como:
se nombra el radical y a continuación se nombra benceno, por ejemplo:
Cuando son dos los radicales sustituyentes, se puede proceder de dos modos distintos: a) Se numeran los carbonos del benceno asignando la posición 1 de modo que correspondan los números más bajos posibles, y se leen los radicales indicando sus posiciones anteponiéndolas a la palabra benceno:
(Se han nombrado los sustituyentes en orden de complejidad creciente.) b) El nombre se deriva de las posiciones relativas de los radicales:
Así, por ejemplo, se nombrarán:
La mayoría de los hidrocarburos aromáticos poseían nombres triviales, la mayoría de los cuales se conservan:
Obtención de los hidrocarburos aromáticos Por destilación del alquitrán de hulla se o tienen benceno, tolueno (metilbenceno), xilenos (dimetilbenceno), naftaleno, antraceno y fenantreno. Los métodos generales de obtención de hidrocarburos bencénicos son: a) Síntesis de Wurtz-Fittig b) Síntesis de Friedel y Crafts
Propiedades físicas y químicas de los hidrocarburos aromáticos Son todos incoloros (el antraceno presenta fluorescencia azulada) muy aromáticos, insolubles en agua y menos densos que ésta. Las reacciones más importantes de los hidrocarburos aromáticos son las de sustitución, en las que un grupo funcional sustituye a uno de los átomos de hidrógeno del anillo aromático: a) Halogenación El benceno en presencia de luz solar adiciona cloro hasta llegar a hexacloro ciclohexano:
b) Nitración Consiste en la sustitución de un hidrógeno por el grupo —NO2, y se produce por la acción del ácido nítrico, en presencia de ácido sulfúrico (mezcla sulfonítrica):
c) Sulfonación Consiste en la sustitución de un hidrógeno por el grupo —SO3H, y se produce por la acción, en caliente, del ácido sulfúrico concentrado:
d) Reacciones de Friedel-Crafts Consisten en la sustitución de un hidrógeno por un radical alquilo,—R, llamada alquilación; o por un radical acilo,—RCO—, llamada acilación. Ambas reacciones se producen, respectivamente, mediante la acción de halogenuros de alquilo, R—X, o de halogenuros de acilo, R—CO—X, en presencia del cloruro de aluminio anhidro, como catalizador. Por ejemplo:
Como puede observarse en la alquilación se producen otros hidrocarburos aromáticos, mientras que la acilación conduce a cetonas aromáticas, siendo el método de Friedel-Crafts muy utilizado para la síntesis de estos compuestos. orto meta para Y se nombran indicando las posiciones relativas de los sustituyentes. Por ejemplo:
DERIVADOS HALOGENADOS DE LOS HIDROCARBUROSCuando se estudiaron las propiedades químicas de los hidrocarburos, se indicó la acción de los halógenos sobre las parafinas, que daba lugar a la formación de compuestos de sustitución de uno o más átomos de hidrógeno por átomos de halógeno. Esta misma acción también se produce en los hidrocarburos no saturados. En la formación de productos de sustitución es muy difícil limitar el proceso o la obtención de un único compuesto halogenado, lo que hace que se empleen otros métodos para producir un derivado mono, di o tri halogenado, correspondiente a un determinado hidrocarburo. Los haluros de los hidrocarburos son compuestos halogenados de los alcanos, los alquenos y los aromáticos o arilos. El halógeno se liga a uno de los carbonos implicados en la doble ligadura y directamente al anillo bencénico o a cualquiera de los átomos de los alcanos. Se clasifican en; • Haluros alquílicos , derivados halogenados de los hidrocarburos saturados • Haluros vinilicos, derivados halogenados de los hidrocarburos saturados • Haluros de arilo, derivados halogenados del benceno NOMENCLATURA En general, la nomenclatura de estos compuestos es relativamente simple. Los más sencillos de estos haluros se designan por el prefijo cloruro, yoduro, bromuro, seguido del nombre del grupo alquílico. Para los mas complejos, se sigue el método sistemático de la IUPAQ , colocando primero los prefijos cloro, yodo, bromo, precedidos de su posición en la cadena carbonada principal , seguido del nombre de esta o sin son aromáticos, seguido de la palabra benceno.
2. Ejemplos de haluros de vinilo 3.Ejemplos de haluros de arilo Derivados halogenados. Son hidrocarburos que contienen en su molécula átomos de halógeno. Se nombran a veces como haluros de alkilo Los derivados halogenados o compuestos halogenados, como su nombre lo dice son compuestos que contienen halogenos. Algunos de los compuestos halogenados son los hidrocarburos halogenados, o sea, los hidrocarburos con halogenos (clorometano, difluoropentano). Los compuestos halogenados pertenecen al grupo funcional de los átomos de halógeno. Tienen una alta densidad. Son usados en refrigerantes, disolventes, pesticidas, repelentes de polillas, en algunos plásticos y en funciones biológicas: hormonas tiroideas. Por ejemplo: cloroformo, diclorometano, tiroxina, Freón, DDT, PCBs, PVC. La estructura de los compuestos halogenados es: R-X, en donde X es Flúor (F), Cloro (Cl), Bromo (Br) y Yodo (I) 2.- Normas a seguir para asignarles nombres a los derivados halogenados. Se nombran anteponiendo el nombre del halógeno (fluoro, cloro, bromo, yodo) al del hidrocarburo correspondiente con el Ejemplos:
ALCOHOLES Y FENOLESLos alcoholes son el grupo de compuestos químicos que resultan de la sustitución de uno o varios átomos de hidrógeno (H) por grupos hidroxilo (-OH) en los hidrocarburos saturados o no saturados. Los fenoles son sustratos muy reactivos a la sustitución aromática electrofílica, porque los electrones no enlazantes del grupo hidroxilo estabilizan al complejo sigma que se forma por ataque en la posición orto o para. Por tanto, se dice que el grupo hidroxilo es muy activante y director orto-para. Los fenoles son sustratos excelentes para halogenación , nitración, sulfonación y algunas reacciones de Friedel-Crafts. Como son muy reactivos, generalmente los fenoles se alquilan o se acilan con catalizadores de Friedel-Crafts, relativamente débiles (como el HF) para evitar sobrealquilación o sobreacilación. Así y todo, las sustituciones electrofílicas aromáticas requieren condiciones mucho más suaves que para el benceno, y la reacción sucede mucho más rápidamente ALCOHOLES Los alcoholes se clasifican en primarios, secundarios y terciarios , dependiendo del número de grupos orgánicos unidos al carbono que lleva el hidroxilo  En la nomenclatura del sistema IUPAC los alcoholes simples se nombran como derivados del alcano progenitor y se utiliza el sujijo -ol REGLA 1 Seleccione la cadena de carbonos mas larga que contenga el grupo hidroxilo y derive el nombre del progenitor reemplazando la terminacion -o del alcano correspondiente con -ol REGLA 2 Numere la cadena del alcano a partir del extremo mas cercano al grupo hidroxilo REGLA 3 Numere los sustituyentes de acuerdo con su posición en la cadena y escriba el nombre enlistando los sustituyentes en orden alfabetico   FENOLES La palabra fenol se utiliza como nombre de una sustancia (hidroxibenceno) o de la familia de los compuestos aromático hidroxisustituidos, de acuerdo con las reglas de los compuestos aromaticos . Note que el -fenol se emplea como el nombre progenitor mas que -benceno.  |
Identificación del producto
Sinónimos: 1,2-etanodiol; glicol; 1,2-Dihydroxyethane; etileno alcohol; Ethulene dihidrato
CAS No.: 107-21-1
Peso molecular: 62,07
Fórmula química: CH2OHCH2OH
Códigos de producto:
Baker JT: 5387, 5845, 9140, 9298, 9300, 9346, 9356, L715
Mallinckrodt: 5001, 5037
2. Composición / información sobre los ingredientes
Ingrediente CAS No Por ciento peligrosos --------------------------------------- ----------- - ------------ --------- El glicol de etileno 107-21-1 99 a 100% Sí
3. Identificación de los riesgos
Descripción general de emergencia
--------------------------
ADVERTENCIA! Dañino o mortal si se ingiere. DAÑINO SI ES inhala o se absorbe por la piel. Puede causar una reacción alérgica en la piel. Puede causar irritación a la piel, ojos y vías respiratorias. Afecta al sistema nervioso central.
SAF-T-DATA (tm) (Proporcionado aquí para su conveniencia)
-------------------------------------------------- -------------------------------------------------- -------
Clasificación de la Salud: 2 - Moderado (Vida)
Inflamabilidad: 1 - Ligero
Reactividad: 1 - Ligero
Capacidad de contactos: 3 - Severo (Vida)
Laboratorio de Protección Equipar: Gafas y SHIELD, bata de laboratorio y plataforma; campana de ventilación, guantes apropiados
Almacenamiento de código de colores: Verde (Almacenaje General)
-------------------------------------------------- -------------------------------------------------- -------
Efectos potenciales para la salud
----------------------------------
Inhalación:
La inhalación de vapor generalmente no es un problema a menos que se calientan o el rocío. La exposición a vapores durante un período de tiempo prolongado ha causado irritación de la garganta y dolor de cabeza. Puede provocar náuseas, vómitos, mareos y somnolencia. El edema pulmonar y depresión del sistema nervioso central también se puede desarrollar. Cuando se calienta o empañado, ha producido, movimientos involuntarios rápidos de los ojos y coma.
Ingestión:
Los síntomas iniciales de la dosis masiva intoxicación de alcohol en paralelo, progresando a la depresión del SNC, vómitos, dolor de cabeza, rápido respiratoria y la frecuencia cardiaca, disminución de la presión arterial, estupor, colapso, pérdida del conocimiento y con convulsiones. La muerte por paro respiratorio o colapso cardiovascular puede seguir. Dosis letal en humanos: 100 ml (3-4 onzas).
Contacto con la piel:
Menor irritación de la piel y la penetración puede ocurrir.
Contacto con los ojos:
Las salpicaduras pueden causar irritación, dolor, daño a los ojos.
Exposición Crónica:
La exposición repetida pequeña por cualquier vía puede causar problemas renales graves. El daño cerebral también pueden ocurrir. Alergia de la piel pueden desarrollar. Puede dañar al feto en desarrollo.
Agravación de Condiciones Pre-existentes:
Las personas con trastornos de la piel existente-pre, problemas oculares o insuficiencia hepática, renal o la función respiratoria pueden ser más susceptibles a los efectos de esta sustancia.
4. Medidas de primeros auxilios
Inhalación:
Saque al aire libre. Si no respira, dar respiración artificial. Si la respiración es difícil, dar oxígeno. Llame a un médico.
Ingestión:
Inducir el vómito inmediatamente como lo indique el personal médico. No dar nada por boca a una persona inconsciente. Obtener atención médica.
Contacto con la piel:
Quítese la ropa contaminada. Lavar la piel con agua y jabón durante al menos 15 minutos. Obtener atención médica si la irritación aumenta o persiste.
Contacto con los ojos:
Inmediatamente lave los ojos con abundante agua durante al menos 15 minutos, levantando los párpados superior e inferior ocasionalmente. Obtenga atención médica inmediatamente.
Nota para el médico:
Dar bicarbonato sódico por vía intravenosa para tratar la acidosis. Un análisis de orina puede mostrar la baja gravedad específica, proteinuria, piuria, cilindruria, hematuria, óxido de calcio, y ácido hipúrico cristales. El etanol puede usarse en el tratamiento antídoto, pero monitor de glucosa sanguínea durante la administración de etanol, ya que puede causar hipoglucemia. Considere la infusión de un diurético como el manitol, para ayudar a prevenir o controlar el edema cerebral y la hemodiálisis para eliminar el glicol de etileno de la circulación.
5. Medidas para combatir incendios
Fuego:
Punto de inflamación: 111C (232F) CC
Temperatura de autoignición: 398C (748 s.)
Límites inflamables en el aire% por volumen:
LEL: 3,2; uel: 15,3
Leve a moderado riesgo de incendio cuando se expone al calor o llama.
Explosión:
Por encima de punto de inflamación, las mezclas de aire-vapor son explosivas dentro de límites inflamables indicados anteriormente. Los contenedores pueden explotar cuando se involucran en un incendio.
Medios Extintores de Incendio:
Químico seco, espuma o dióxido de carbono. El agua o la espuma pueden causar espuma. Rocío de agua puede ser utilizada para extinguir el fuego que lo rodea y enfriar los contenedores expuestos. El rocío de agua reducirán también los gases de humo y un irritante.
Información especial:
En el caso de un incendio, use ropa protectora completa y aprobado por NIOSH autónomo de respiración con mascarilla completa operando en la demanda de presión o modo de presión positiva de otros. gases y vapores tóxicos pueden ser liberados si interviene en un incendio.
6. Medidas de liberación accidental
Ventile el área de la fuga o derrame. Retirar todas las fuentes de ignición. Use equipo de protección personal como se especifica en la Sección 8. Aislar el área de peligro. La subsistencia y sin protección personal innecesario entrar. Contenga y recupere el líquido cuando sea posible. Utilice herramientas que no produzcan y equipo. Recoger el líquido en un recipiente adecuado o absorber con un material inerte (ej. vermiculita, arena seca, tierra) y colóquelo en un recipiente para residuos químicos. No use materiales combustibles, tales como el serrín. No lo tire a la alcantarilla! Las Regulaciones de EE.UU. (CERCLA) requieren que se reporten los derrames y la eliminación en suelo, agua y aire en exceso de cantidades reportables. El número gratuito para los EE.UU. de la Guardia Costera Centro Nacional de Respuesta es (800) 424-8802.
7. Manipulación y almacenamiento
Guardar en un recipiente bien cerrado, almacenado en un lugar fresco, seco y ventilado. Proteger contra daños físicos. Separar de ácidos y materiales oxidantes. Los envases de este material pueden ser peligrosos cuando están vacíos ya que retienen residuos del producto (vapores, líquido); a las advertencias y precauciones listadas para el producto.
8. Controles de exposición / Protección personal
Límites de Exposición Aérea:
[El glicol de etileno 107-21-1]:
ACGIH-La exposición a corto plazo límite (STEL):
100 mg/m3, techo (aerosoles sólo)
Sistema de Ventilación:
Un sistema de locales y / o general es recomendado para las exposiciones de empleados debajo de los Límites de Exposición Aérea. Extracción local es generalmente preferida porque puede controlar las emisiones del contaminante en su fuente, impidiendo dispersión del mismo al lugar general de trabajo. Por favor, consulte el documento de la ACGIH, Ventilación Industrial, Un Manual de Prácticas Recomendadas, edición más reciente, por detalles.
Respiradores Personales (Aprobados por NIOSH):
Si el límite de exposición es excedido, un respirador de media cara con un cartucho para vapores orgánicos y filtro de partículas (tipo NIOSH P95 o R95 filtro) puede ser utilizado hasta por diez veces el límite de exposición o la concentración máxima de uso especificada por la agencia reguladora apropiada o proveedor del respirador, que sea más bajo. Un rostro pieza respirador con un cartucho para vapores orgánicos y filtro de particulas (NIOSH P100 R100 o filtro) se pueden usar hasta 50 veces el límite de exposición, o la concentración máxima de uso especificada por la agencia reguladora apropiada o el proveedor del respirador, lo que sea menos . Tenga en cuenta que los filtros serie N no se recomiendan para este material.Para emergencias o casos donde los niveles de exposición no son conocidos, use un pedazo cara llena de presión positiva,-respirador con suministro de aire. ADVERTENCIA:-respiradores purificadores de aire no protegen a los trabajadores en atmósferas deficientes de oxígeno.
Protección de la piel:
Use guantes protectores y ropa limpia que cubra el cuerpo.
Protección para los ojos:
Usar gafas de seguridad química. Mantenga lava ojos y las instalaciones de moje rápido en el área de trabajo.
9. Propiedades físicas y químicas
Aspecto:
Borrar líquido aceitoso.
Olor:
Inodoro.
Solubilidad:
Miscible en agua.
Peso específico:
@ 1,1 20C/4C
pH:
No se encontró información.
Los volátiles% en volumen @ 21C (70F):
100
Punto de ebullición:
197.6C (388 septies)
Punto de fusión:
-13C (9F)
Densidad del vapor (Aire = 1):
2,14
Presión de vapor (mm Hg):
0,06 @ 20C (68F)
Velocidad de evaporación (BuAc = 1):
No se encontró información.
10. Estabilidad y reactividad
Estabilidad:
Estable bajo condiciones ordinarias de uso y almacenamiento.
Productos de descomposición peligrosos:
El dióxido de carbono y monóxido de carbono puede formarse cuando se calienta hasta la descomposición. Puede producir humo acre y humos irritantes cuando se calienta hasta la descomposición.
Polimerización peligrosa:
No se producirá.
Incompatibilidades:
Agentes oxidantes fuertes. Reacciona violentamente con ácido clorosulfónico, óleum, ácido sulfúrico, ácido perclórico. Las causas de ignición a temperatura ambiente con trióxido de cromo, permanganato de potasio y peróxido de sodio, las causas de ignición a 212F (100C) con dicromato de amonio, el clorato de plata, cloruro de sodio y nitrato de uranilo.
Condiciones que deben evitarse:
Calor, llamas, fuentes de ignición, el agua (absorbe con facilidad) e incompatibles.
11. Información Toxicológica
Datos toxicológicos:
DL50 oral rata: 4700 mg / kg; DL50 piel del conejo: 9530 mg / kg.
Irritación - piel de conejo: 555 mg (abierto), leve; Ojo de conejos: 500mg/24H, leve.
Investigado como tumorígeno, mutagénico y causante de efectos reproductivos.
Toxicidad reproductiva:
Se ha demostrado efectos teratogénicos en animales de laboratorio.
-------- Cáncer \ Listas \ -------------------------------------- ---------------- --- --- NTP Carcinógeno Ingrediente Conocido Anticipado Categoría IARC ------------------------------------ ----- --------- - ------------- El glicol de etileno (107-21-1) No No Ninguno
12. Información sobre la ecología
Destino Ambiental:
Cuando se elimina en el suelo, este material se espera que biodegradan fácilmente. Cuando se elimina en el suelo, este material se espera que se filtre en las aguas subterráneas. Cuando se elimina en el suelo, este material no se espera que se evapore de forma significativa. Cuando se elimina en el agua, este material se espera que biodegradan fácilmente. Cuando se elimina en el agua, este material se espera que tenga una vida media entre 1 y 10 días.Este material no es de esperar una bioacumulación significativa. Este material tiene una partición octanol-agua registro coeficiente inferior a 3,0. Cuando se elimina en el agua, este material no se espera que se evapore de forma significativa. Cuando se elimina en el aire, este material se espera que sea rápidamente degradado por reacción con radicales hidroxilo producidos fotoquímicamente. Cuando se elimina en el aire, este material se espera que tenga una vida media entre 1 y 10 días.
Toxicidad Ambiental:
Los valores de LC50/96-horas para peces son superiores a 100 mg / l.
13. Consideraciones sobre la eliminación
Lo que no se pueda conservar para recuperación o reciclaje debe ser manejado en una instalación de eliminación de residuos adecuadas y aprobadas.El procesamiento, utilización o contaminación de este producto puede cambiar las opciones de gestión de residuos. Estado y la eliminación de las regulaciones locales pueden diferir de las regulaciones federales de desecho. Deseche el envase y el contenido no utilizado de conformidad con, estatales y locales con los requisitos federales.
14. Información sobre el transporte
No está regulado.
15. Información sobre normativas
-------- Químicas \ Estado de inventario - Parte 1 \ --------------------------------- Ingrediente TSCA CE Japón Australia ----------------------------------------------- --- - --- ----- --------- El glicol de etileno (107-21-1) Sí Sí Sí Sí -------- Químicas \ Estado de inventario - Parte 2 \ --------------------------------- - Canadá - Ingrediente Corea del DSL NDSL Phil. ----------------------------------------------- --- - --- ---- ----- El glicol de etileno (107-21-1) Sí Sí No Sí -------- \ Federales, estatales y Regulaciones Internacionales - Parte 1 \ ---------------- -SARA 302 - SARA ------ ------ 313 Ingrediente RQ TPQ Lista Química Catg. ----------------------------------------- ----- --- - --- -------------- El glicol de etileno (107-21-1) No No Sí No -------- \ Federales, estatales y Regulaciones Internacionales - Parte 2 \ ---------------- -RCRA--TSCA- Ingrediente CERCLA 261.33 8 (d) ----------------------------------------- ------ --- --- ------ Glicol de etileno (107-21-1) 5000 No No
Éteres
| Nomenclatura | Fórmula | Estructura 3D |
| nombre de la clase funcional = alquil alquil éter etílico por ejemplo, metil éter prefijo = sustituyente alcoxi-por ejemplo, methoxyethane |  |
Ejemplos de cómo cada uno de los tipos de nomenclatura se aplican son los siguientes. Ningún método es más correcta que la otra, pero algunas orientaciones sobre las prácticas más habituales se da.
Nota: los ejemplos escogidos para ilustrar el subsistema de nombres.
En la práctica, estos ejemplos es probable que se designe a todos los éteres de alquilo de alquilo.
"Simple" éteres
- Si ambos grupos son simples grupos alquilo, el éter es usualmente nombrada como el éter de alquilo de alquilo
- Los grupos alquilo se enumeran en orden alfabético
- Si los dos grupos alquilo son iguales, entonces es un éter dialquil
etil metil éter | CH 3 CH 2 OCH3 | |
| CH 3 CH 2 OCH2 CH 3 |
"Intermedio" éteres
- Si uno de los grupos es más compleja que el grupo éter generalmente se considera como un alcoxi (es decir, RO-) sustituyente.
- El complejo grupo de más (es decir, la cadena más larga, más ramificado, otros sustituyentes) define la raíz.
1-methoxypropane | CH 3 CH 2 CH 2OCH 3 | |
2-methoxypropane | CH 3 CH (OCH 3)CH 3 |
"Complejo" éteres
- Si ambos grupos son complejos entonces el éter puede ser identificado con oxa-
| CH 3 OCH 2 CH 2 CH3 |
La última vez que vimos las reacciones de los ésteres con hidruro de litio y aluminio y con reactivos de Grignard. Seguimos a que con la química de enolatos forma a partir de ésteres y luego miró a las grasas y jabones. Hoy vamos a mirar a los padres grupo funcional de los derivados de ácidos carboxílicos, el grupo ácido carboxílico sí mismo. Vamos a ver cómo podemos hacer que los ácidos carboxílicos y preguntar por qué son los ácidos.
Hay dos tipos de reacciones que pueden hacer los ácidos carboxílicos. Vamos a mirar primero a aquellos que dependen de la oxidación de los grupos de un nivel de oxidación más bajo (menos de oxígenos, más hidrógenos). Entonces veremos que hay reacciones que hacen un enlace carbono-carbono en el camino para hacer un ácido carboxílico.
Como puede suponerse, los ácidos carboxílicos se pueden hacer mediante la oxidación de los grupos que son menos oxidado. El más importante de ellas es el grupo alcohol primario. Una reacción típica es:
Reconocemos el agente oxidante, dicromato de potasio, como el mismo reactivo que se utilizó en la oxidación de aldehídos a ácidos carboxílicos. El cromo se encuentra en el nivel de oxidación y las seis de dicromatos se reduce a tres niveles de oxidación en este proceso. Los detalles de la reducción del cromato son complejas, y no vamos a preocuparnos por ellos. La oxidación de aldehídos también produce ácidos carboxílicos, aldehídos, pero desde hace menos fácilmente que los ácidos carboxílicos, este proceso no se utiliza mucho.
Otro proceso oxidativo parece en un principio para no involucrar a un grupo funcional. Los grupos alquilo (por lo general los grupos de metilo) están conectados directamente a un anillo aromático también se oxidan a ácidos carboxílicos. Dado que el grupo metilo sólo contiene enlaces CH sigma, no se ve como un lugar probable para la reacción. Está influida por el anillo aromático neigboring, aunque, así se produce la reacción. Esto es algo así como la reactividad especial de la CH bonos alfa de una cetona o aldehído. He aquí un ejemplo:
Recuerde, esta reacción requiere la presencia de un anillo aromático junto al grupo alquilo que ha de ser oxidada. Cualquier carbones más allá de la primera de ellas se pierden en este proceso, que es una de las pocas reacciones que rompe un enlace carbono-carbono.
Hay dos secuencias de reacciones que hacen que los bonos de carbono-carbono en el camino a los ácidos carboxílicos. El primero es otro uso del reactivo de Grignard. Recuerde que los reactivos de Grignard reaccionan con compuestos carbonílicos hacer alcoholes. Si bien no solemos pensar en él de esa manera, el dióxido de carbono es aa compuesto carbonílico (O = C = O). Si un reactivo de Grignard son utilizados para entregar un átomo de carbono nucleófilo al carbono carbonilo del dióxido de carbono, se obtiene un ácido carboxlic (después del temple con ácido acuoso).
El ataque del reactivo de Grignard sobre el dióxido de carbono es directamente análoga a la misma medida en las reacciones de otros compuestos carbonílicos:
Aquí está toda la secuencia presentada en el formato más compacto que utilizamos para las adiciones de Grignard anterior:
Tenga en cuenta que el producto tiene un átomo de carbono más que el bromoalkane comenzamos con, y que este carbono está en un grupo ácido carboxílico.
También hay otra manera de hacer un nuevo carbono-fianza y cerrar con un ácido carboxílico. Si tenemos un haluro de alquilo primario (principal medio de que el carbono que está unido al halógeno está unido a otros un átomo de carbono solamente, los otros dos enlaces son a hidrógeno), podemos reaccionar con cianuro de sodio. El ion cianuro reemplazará el halógeno, y esto hace que un enlace carbono-carbono nueva. El producto se llama un nitrilo. carbono-nitrógeno de bonos triple Su pueden ser hidrolizados con ácido acuoso para producir un ácido carboxílico. La secuencia es la siguiente (por lo general, el nitrilo es aislado y, a continuación hidroliza en una reacción por separado):
No vamos a mirar los detalles de los mecanismos de cualquiera de estas reacciones ahora. Usted Sería conveniente que especular acerca de la hidrólisis del nitrilo. Usted podría empezar por pensar en el triple enlace CN como si fuera un grupo carbonilo. Después de todo, incluye un enlace pi entre el carbono y un átomo electronegativo, al igual que el enlace pi en un grupo carbonilo.
La cuestión pendiente con los ácidos carboxílicos es entender por qué son ácidas. Podemos experimentar su grado de acidez en vinagre sabor - que es una solución diluida de ácido acético en agua. El modelo de Bronsted-Lowry de ácidos es útil para esto. Vamos a refrescar nuestra memoria sobre este modelo y en la interpretación de la pK un plazo.
Cuando pensamos en ácidos utilizando el modelo de Lowry-Bronsted, pensamos en una molécula que puede donar un protón (H +). Una base es una molécula que puede aceptar un protón (utilizando el par de electrones que son el rasgo definitorio de una base de Lewis). Los ácidos más fuertes donar protones fácilmente a fuertes bases. Los productos de esta transacción son ácidos más débiles y más débiles bases. Aquí está el patrón.
Aviso sobre todo que un ácido fuerte es fuerte porque fácilmente dona un protón. Esto significa que su base conjugada (la base que queda después de que el protón se ha ido) es débil. Después de todo, si la base eran fuertes, se agarraba la espalda y el protón del ácido no podía desprenderse de él. Cuando describimos un ácido más fuerte, diciendo que tiene un pK un pequeño, también estamos diciendo que su base conjugada es débil. HCl es un ácido fuerte (pK a -7). Cuando decimos que, también estamos diciendo que el Cl - es una base débil. La base conjugada de un ácido cuya pK a es pequeño o negativo es una base débil. Esto significa que podemos utilizar un pK una tabla como la Tabla 2.1 en la p 43 de Brown para hacer un seguimiento tanto de acidez (ácidos fuertes tienen o negativo pK unapequeña "s) y basicidad (bases débiles provienen de ácidos fuertes con o negativos pK pequeños 's a).
Esto también significa que podemos reformular la pregunta: "¿Por qué los ácidos carboxílicos ácidos? a decir "¿Por qué son las bases conjugadas de los ácidos carboxílicos tales bases débiles?" Para poner esto en contexto, el aviso de que los ácidos carboxílicos tienen un pK 's de cerca de 5, mientras que el agua y los alcoholes tienen un pK' s de cerca de 16. Lo que hace que la base conjugada (vamos a llamarlo un ion carboxilato) de un ácido carboxílico tan débil en comparación con un hidróxido (OH -) o alcóxido (RO -) ion?
Como de costumbre, vamos a tratar de encontrar nuestras explicaciones en la estructura. Hay una diferencia obvia entre un ion carboxilato y un ion alcóxido. El ion carboxilato tiene dos oxígenos electronegativos a una sola para el ion alcóxido. Estos átomos electronegativos celebrará los pares de electrones con más fuerza, lo que significa que los pares de electrones sería menos disponible para hacer un enlace a un protón. Menos pares de electrones disponibles, una base más débil.
Eso explica algunas de las debilidades de los iones carboxilato como bases, pero también hay una sutil largometrajes más. Nótese que podemos mover electrones entre pi-vinculación y el par no compartido situaciones sin cambiar la estructura del ion carboxilato. Reconocemos esto como resonancia y reconocemos que reducirá la energía de un ion carboxilato en comparación con la de un ion alcóxido en el que la resonancia no es posible. Baja energía significa más estable, más se forman fácilmente y menos reactivo, todo lo cual se suma a una base más débil. En consecuencia, el ácido carboxílico conjugada es más fuerte que aquel cuya base conjugada no tiene la posibilidad de resonancia.
El resultado paradójico de esto es algo que los ácidos carboxílicos son ácidos más fuertes que los alcoholes porque los iones carboxilato, sus bases conjugadas son bases más débiles que alcóxidos. Esto se debe en gran parte a la estabilización de resonancia de los iones carboxilato, que no puede suceder en alcóxidos.
Esta comprensión de la estructura de los iones carboxilato también nos ayuda a comprender cómo es que cuando un reactivo de Grignard reacciona con el dióxido de carbono, sólo uno de los dos grupos carbonilo reacciona. El producto de esta reacción es un ion carboxilato. Es estabilizado por resonancia por lo que el "real" es la estructura a medio camino entre las dos estructuras de resonancia. Eso significa que cada enlace CO está a medio camino entre un sencillo y un doble enlace - un bono y medio. Esa fianza sería mucho menos reactivo que el doble enlace de un grupo carbonilo, por lo que no es de extrañar que el reactivo de Grignard reacciona con el dióxido de carbono en lugar de la de iones carboxilato.