|
|
Orbital atómico
Un orbital atómico es una determinada solución particular, espacial e independiente del tiempo a la ecuación de Schrödinger para el caso de unelectrón sometido a un potencial coulombiano. La elección de tres números cuánticos en la solución general señalan unívocamente a un estado monoelectrónico posible.
Estos tres números cuánticos hacen referencia a la energía total del electrón, el momento angular orbital y la proyección del mismo sobre el eje z del sistema del laboratorio y se denotan por
El nombre de orbital también atiende a la función de onda en representación de posición independiente del tiempo de un electrón en unamolécula. En este caso se utiliza el nombre orbital molecular.
La combinación de todos los orbitales atómicos dan lugar a la corteza electrónica representado por el modelo de capas electrónico. Este último se ajusta a los elemento según la configuración electrónicacorrespondiente.
Orbital híbrido
Cada uno de los orbitales equivalentes que pueden obtenerse mediante combinación lineal de orbitales atómicos distintos. La hibridación de orbitales da como resultado orbitales de enlace que son combinación lineal de sus componentes. Los orbitales híbridos más generalizados son los siguientes: sp, sp2, sp3 y spd. Los orbitales moleculares, que representan la distribución espacial de los electrones de enlace en una molécula, son, fundamentalmente, orbitales híbridos.
Las formas de las moléculas enlazadas por hibridaciones de sus orbitales es forzada por los ángulos entre sus átomos:
Sin hibridación: forma lineal
Hibridación sp: forma lineal con ángulos de 180°
Hibridación sp
: forma trigonal plana con ángulos de 120°. Por ejemplo B Cl 3?.
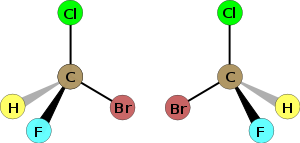
Hibridación sp³: forma tetraédrica con ángulos de 109.5°. Por ejemplo C Cl 4?.
Hibridación sp³d: forma trigonal bipiramidal con ángulos
ENLACE IÓNICO
Los compuestos iónicos resultan normalmente de la reacción de un metal de bajo potencial de ionización, con un no metal. Los electrones se transfieren del metal al no metal, dando lugar a cationes y aniones, respectivamente. Estos se mantienen unidos por fuerzas electrostáticas fuertes llamadas enlaces iónicos.
NATURALEZA DEL ENLACE COVALENTE
El enlace de tipo covalente se produce entre elementos no metálicos, o no metálicos con el hidrógeno, es decir entre átomos de electronegatividades semejantes y altas en general. Se debe generalmente a la compartición de electrones entre los distintos átomos. En algunos casos puede darse un enlace covalente coordinado o dativo, en el que uno sólo de los átomos cede los dos electrones con que se forma el enlace.
ESTRUCTURAS DE LEWIS, REGLA DEL OCTETO.
Lewis fue uno de los primeros en intentar proponer una teoría para explicar el enlace covalente, por ello creo notaciones abreviadas para una descripción más fácil de las uniones atómicas, que fueron las estructuras de Lewis.
Regla del octeto: “Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la estructura electrónica del gas noble más cercano en el sistema periódico”.
PROPIEDADES DE LOS ENLACES.
Propiedades de las sustancias iónicas:
Las sustancias iónicas se encuentran en la naturaleza formando redes cristalinas, por tanto son sólidas.
Su dureza es bastante grande, y tienen por lo tanto puntos de fusión y ebullición altos.
Son solubles en disolventes polares como el agua.
Cuando se tratan de sustancias disueltas tienen una conductividad alta.
Propiedades de los compuestos covalentes.
Los compuestos covalentes suelen presentarse en estado líquido o gaseoso aunque también pueden ser sólidos. Por lo tanto sus puntos de fusión y ebullición no son elevados.
La solubilidad de estos compuestos es elevada en disolventes polares, y nula su capacidad conductora.
Los sólidos covalentes macromoleculares, tienen altos puntos de fusión y ebullición, son duros, malos conductores y en general insolubles.
Los enlaces metálicos:
Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente.
Las conductividades térmicas y eléctricas son muy elevadas.
Presentan brillo metálico.
Son dúctiles y maleables.
Pueden emitir electrones cuando reciben energía en forma de calor.
Enlace iónico: que se suele dar entre un metal y un no metal. Y que da lugar a estructura de redes cristalinas.
El enlace metálico, que se da entre dos metales.
Y el enlace covalente, que se da entre dos no metales o no metal e hidrógeno. Este se suele representar a través de estructuras de Lewis, que cumplen la regla del octeto, aunque puede haber alguna excepción a dicha regla.
Los electrones , especialmente los que están en la capa más externa (capa de valencia), juegan un papel fundamental en el enlace químico.
En algunos casos se transfieren electrones de un átomo a otro, formándose iones positivos y negativos que se atraen entre sí mediante fuerzas electrostáticas denominadas enlaces iónicos.
En otros casos se comparten entre los átomos uno o más pares de electrones, esta compartición de electrones se denomina enlace covalente.
Los electrones se transfieren o se comparten de manera que los átomos adquieren una configuración electrónica especialmente estable. Generalmente se trata de una configuración de gas noble con ocho electrones más externos que constituyen un octeto.
Éstos son elementos del grupo VA (15). Sus átomos tienen todos cinco electrones de valencia (ns2np3). Los símbolos de Lewis tienen cinco puntos:
El Al está en el grupo IIIA (13); el I en el VIIA(17); el Se en el VIA(16) ; el Ar en el VIIIA (18)
Las moléculas que presentan como átomo central a elementos del tercer período en adelante, pueden presentar octetos expandidos, porque además de los orbitales ns, np, disponen de orbitales nd que no están llenos, los cuales pueden usar para enlazarse. Por ejemplo el fósforo, P, tiene una configuración de capa de valencia 3s23p3. Al usar sólo estos orbitales 3s y 3p, el átomo de fósforo puede aceptar solamente 3 electrones adicionales, y formar tres enlaces covalentes, como en el PF3. Sin embargo, se pueden formar más enlaces si se utilizan los orbitales 3d vacíos del átomo, como el PCl5.
ENLACE METÁLICO.
El enlace metálico es el que mantiene unido a los átomos de los metáles entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales muy compactas.
RESUMEN.
Los tres tipos de enlaces más frecuentes en las moléculas, son:
Teoría de Lewis.
Ideas básicas:
Símbolos de Lewis y estructuras de Lewis.
Un símbolo de Lewis consiste de un símbolo químico que representa el núcleo y los electrones internos de un átomo, junto con puntos situados alrededor del símbolo representando a los electrones más externos (electrones de la capa de valencia). Así el símbolo de Lewis para el silicio que tiene la configuración [Ne]3s23p2 es:
![]()
para escribir los símbolos de Lewis se sitúan puntos solitarios en los lados del símbolo hasta un máximo de cuatro y luego se van pareando hasta formar un octeto. Los símbolos de Lewis se escriben habitualmente para los elementos de los grupos principales y en raras ocasiones para los elementos de transición.
Ejemplo1. Escritura de los símbolos de Lewis.
Escriba símbolos de Lewis para los siguientes elementos: a) N, P, As, Sb, Bi b) Al, I, Se, Ar.
Solución: |
|
|
Para los elementos de los grupos principales el número de electrones de valencia y por ende el número de puntos que aparecen en un símbolo de Lewis es igual al número del grupo en la tabla periódica.
Una Estructura de Lewis es una combinación de símbolos de Lewis que representa la transferencia o compartición de electrones en un enlace químico.
Consideraciones al momento de escribir estructuras de Lewis.
- Generalmente todos los electrones de una estructura de Lewis están apareados.
- Generalmente cada átomo adquiere como estructura externa un octeto de electrones. Sin embargo, el hidrógeno se limita a una capa externa de dos electrones(dueto)
- Algunas veces son necesarios enlaces covalentes dobles o triples. Los átomos C, N, O, P y S son los que más fácilmente forman enlaces covalentes múltiples.
- Determinar el esqueleto de una estructura, para ello considerar que: Los átomos de Hidrógeno son siempre átomos terminales y los átomos de carbono son casi siempre centrales.
Método para escribir estructuras de Lewis:
1.- Determine el número total de electrones de valencia para la molécula, sumando el número de electrones de valencia (igual al número de grupo) para cada átomo. Si escribe la fórmula para de Lewis de un anión poliatómico, adicione el número de cargas negativas a este total.(Para CO32- adiciones dos porque la carga 2- indica que hay dos electrones más de los electrones proporcionados por los átomos neutros). Para un catión poliatómico, reste el número de cargas positivas del total.(Para NH4+ se resta 1).
2.- Identifique el átomo o átomos centrales. Suele tratarse del átomo con la menor electronegatividad. El Hidrógeno, sin embargo, nunca es un átomo central.
3.- Escriba el esqueleto de la estructura básica y una los átomos mediante enlaces covalentes simples.
4.- Por cada enlace simple formado, reste dos electrones del número total de electrones de valencia.
5.- Con los electrones de valencia restantes complete primero los octetos de los átomos terminales y después complete, en la medida posible, los octetos del átomo o átomos centrales.
6.- Si al átomo o átomos centrales les falta un octeto, formar enlaces covalentes múltiples transformando electrones de pares no enlazados de los átomos adyacentes en pares de electrones enlazantes.
Ejemplo2. Aplicación del método general para escribir una estructura de Lewis.
El cloruro de carbonilo o fosgeno, COCl2, es un gas sumamente tóxico empleado como materia prima para la preparación de plásticos de poliuretano. ¿Cuál es la fórmula de Lejía para el COCl2?
Solución:
El número de electrones de valencia de un átomo es igual al número de grupo: 4 para C, 6 para O y 7 para cada Cl, se tiene un total de 24 electrones. Se espera que la estructura básica tenga el C como átomo central,(es el menos electronegativo de los tres átomos), con los átomos de O y Cl (más electronegativos) enlazados a él. Después de unir los átomos por pares de electrones y distribuir los electrones entre los átomos exteriores, se tiene
| La estructura tiene los 24 electrones de valencia, pero, deja al carbono con 6 electrones solamente, y este no cumple octeto. Si mueve un par de electrones del átomo de O para dar un doble enlace carbono oxígeno, la estructura de Lewis del COCl2 es |
Cada átomo tiene octeto |
Ejemplo3. Escritura de la fórmula de Lewis de una especie iónica. Obtenga la estructura de Lewis del ion BF4-.
Solución:
El total de electrones de valencia proporcionados por el boro y cuatro átomos de flúor es 3+(4x7) = 31. Como el enión tiene una carga 1-, tiene un electrón más que los proporcionados por los átomos neutros.. Así , el número total de electrones de valencia de valencia es 32 (o 16 pares de electrones). Como el boro es el elemento menos electronegativo, es el átomo central, con los átomos de F enlazados a él. Después de conectar el B y los átomos de F por pares de electrones, y luego completar los octetos de cada átomo de F con los electrones restantes se tiene:
| La carga del ion, se indica por el signo menos como superíndice del paréntesis cuadrado que encierra la estructura de Lewis. |
Ejemplo 4. Escritura de las estructuras de Lewis de compuestos iónicos.
Escriba la estructura de Lewis para el óxido de bario, BaO.
Solución: Escriba el símbolo de Lewis y determine cuántos electrones debe ganar o perder cada átomo para adquirir la configuración de un gas noble. El Ba ([Xe] 6s2) pierde los dos electrones 6s y el O ([He] 2s2 2p4) gana dos electrones quedando con configuración [He] 2s2 2p6. |
Símbolos de Lewis Estructura de Lewis | |
Símbolos de Lewis Estructura de Lewis | El cloruro de sodio (la sal de mesa) es un ejemplo de enlace iónico: en él se combinan sodio, Na ([Ne] 3s1) y cloro, Cl ( [Ne] 3s23p5), perdiendo el primero un electrón que es capturado por el segundo: NaCl Na+Cl-. La diferencia entre las cargas de los iones provoca entonces la fuerza de atracción electrostática que los mantiene unidos. | |
En solución, los enlaces iónicos pueden romperse y se considera entonces que los iones están disociados. Es por eso que una solución fisiológica de cloruro de sodio y agua se marca como "Na+ + Cl-" mientras que los cristales de cloruro de sodio se marcan "Na+Cl-" o simplemente "NaCl".
Con excepción de pares iónicos como (Na + Cl -) que pueden encontrarse en fase gaseosa, las unidades fórmula de los compuestos iónicos no existen como entidades separadas, sino que cada catión está rodeado por aniones y cada anión por cationes . Estos iones, en número muy grande, se disponen en redes ordenadas denominadas cristales iónicos.
Enlace covalente simple, doble y triple
La compartición de un par de electrones entre átomos enlazados da lugar a un enlace covalente simple. | Par enlazante !
Formación de una molécula de H2 | |
La compartición de dos pares de electrones entre átomos enlazados da lugar a un enlace covalente enlace covalente doble. | Dos pares enlazantes !
Formación de una molécula de O2 | |
Cada átomo de O tiene 6 electrones, la única manera de que cada átomo cumpla octeto es que cada átomo comparta dos pares de electrones con el otro átomo, lo que da origen a un enlace covalente doble.
La compartición de tres pares de electrones entre átomos enlazados da lugar a un enlace covalente triple. | Tres pares enlazantes !
Formación de una molécula de N2 El enlace covalente triple del N2 es un enlace muy fuerte, difícil de romper en una reacción química. La excepcional fuerza de este enlace hace que el N2 (g) sea bastante inerte. Debido a ello, el N2 (g) coexiste con el O2 en la atmósfera y solamente se forman óxidos de nitrógeno en cantidades de trazas a altas temperaturas. La falta de reactividad del N2 hacia el O2 es una condición esencial para la vida en la tierra. |
Enlace covalente polar: enlace covalente en el que dos átomos no comparten por igual los electrones. En estos enlaces los electrones se desplazan hacia el elemento más electronegativo, generándose una separación de carga parcial, quedando el átomo más electronegativo con una carga parcial negativa(- ) y el menos electronegativo con una carga parcial positiva (+ ).
A partir de los valores de electronegatividad, EN, se puede describir la polaridad de un enlace covalente. Para ello se utiliza la diferencia de electronegatividad, EN, que es el valor absoluto de la diferencia de los valores de EN en los átomos enlazados. Si el valor de EN de los dos átomos es muy pequeño, el enlace entre ellos es esencialmente covalente. Si EN, es grande, el enlace es esencialmente iónico. Para valores intermedios de EN, el enlace se considera covalente polar.
Ejemplo 5: Estimación de las diferencias de electronegatividad y de la polaridad de los enlaces.
¿Qué enlace es más polar, H -Cl o H -O?
Solución:
ENH = 2,1 ENCl = 3,0 ENO= 3,5
ENH-Cl = 3 - 2,1 = 0,9 ENH-O = 3,5 - 2,1= 1,4 El enlace H - O es más polar, porque existe una mayor diferencia de electronegatividad entre los átomos que comparten el par electrónico.
Enlace covalente coordinado: El par electrónico compartido es aportado sólo por uno de los átomos. El átomo que aporta el par electrónico se denomina “dador” y el que lo recibe “aceptor”. | Formación del ion amonio |
RESONANCIA.
Hasta el memento hemos considerado que los pares de electrones enlazantes se localizan entre los dos átomos. Para algunas moléculas, los datos experimentales referidos a longitudes de enlace, no se ajustan a la estructura de Lewis escrita. Por ejemplo, para la molécula de ozono, O3, podemos escribir las siguientes estructuras de Lewis. |
|
En la fórmula A, el enlace oxígeno-oxígeno a la izquierda es un doble enlace y en la unión oxígeno-oxígeno a la derecha es un enlace simple. En la estructura B, la situación es exactamente la opuesta.
Pero experimentalmente se encuentra que en el O3, las distancias oxígeno - oxígeno son idénticas, y corresponden a una longitud de enlace de 127,8 pm; la cual es menor a la de un enlace simple y mayor a la de un enlace doble. Los enlaces en el ozono son enlaces intermedios entre un enlace simple y un enlace doble. La estructura de Lewis para el O3, es un híbrido de resonancia de las posibles estructuras contribuyentes. Las estructuras aceptables que contribuyen al híbrido de resonancia deben tener todas el mismo esqueleto, solamente pueden diferir en la distribución de los electrones dentro de la estructura, así la estructura de Lewis para el O3, queda representada por

Donde la flecha , indica que la estructura real de la molécula está compuesta de estas fórmulas de resonancia.
Excepciones a la regla del octeto
Algunas moléculas como el NO, tienen un número impar de electrones, y no se puede satisfacer la regla del octeto. Otras excepciones caen en dos grupos: a)moléculas con un átomo que tiene menos de ocho electrones (octeto incompleto) alrededor de él y b) moléculas en que un átomo tiene más de ocho electrones a su alrededor (octeto expandido).
a) Las moléculas con octeto incompleto contienen principalmente átomos del grupo IIA, BeCl2 y IIIA, BF3.
Geometría molecualr y teoría del enlace químico
La geometría molecular es la forma de una molécula determinada por las posiciones relativas de los núcleos atómicos.
Teoría de la repulsión de pares de electrones de la capa de valencia (RPCV) predice las formas de las moléculas y los iones en los cuales los pares de electrones en la capa de valencia están acomodados alredor del átomo , de modo que los pares electrónicos se conservan tan lejos como pueden uno del otro, minimizando así las repulsiones entre ellos.
Por ejemplo, si hay solo dos pares de electrones en la capa de valencia de un átomo, estos pares tienden a estar en los lados opuestos del núcleo , así se minimiza la repulsión. Esto da una disposición lineal de los pares electrónicos ; es decir los pares electrónicos ocupan principalmente regiones del espacio a un ángulo de 180º uno del otro. |
|
Si hay tres pares electrónicos en la capa de valencia de un átomo, tienden a estar acomodados en un plano, dirigidos hacia los vértices de un triangula de lados iguales( triángulo equilátero). Esta acomodación es plana trigonal, en la cual las regiones del espacio ocupadas por pares electrónicos están dirigidas en ángulos de 120º uno respecto del otro. |
|
Cuatro pares electrónicos en la capa de valencia de un átomo tienden a tener una disposición tetraédrica. Esto es, si se imagina al átomo en el centro de un tetraedro regular, cada región del espacio en el cual queda principalmente un par de electrones se extiende a los vértices del tetraedro, quedando cada par electrónico uno respecto a otro a 190,5º. |
|
Para predecir las posiciones relativas de los átomos alrededor de un átomo dado, empleando la teoría RPCV, primero se debe considerar la acomodación de los pares electrónicos de la capa de valencia alrededor del átomo central. Alguno de estos pares electrónicos son pares enlazantes y otros, pares no enlazados. La dirección en el espacio de los pares enlazantes da la geometría a la molecular.
Pares de electrones | Notación RPCV | Geometría molecular | Ángulos de enlace | Ejemplo | ||
Total | De enlace | Solitarios | ||||
2 | 2 | 0 | AX2 | X __A __X Lineal | 180º | BeCl2 Cl _Be_Cl |
3 | 3 | 0 | AX3 |
Plana trigonal | 120º | BF3
|
2 | 1 | AX2E |
Angular | 120º | SO2
| |
4 | 4 | 0 | AX4 |
tetraédrica | 109,5º | CH4
|
3 | 1 | AX3E |
Piramidal trigonal | 107º | NH3
| |
2 | 2 | AX2E2 |
Angular | 105º | H2O
| |
Ejemplo: Predicción de la geometría de una molécula con enlace múltiple. A partir de la teoría RPECV. :Prediga la geometría molecular del formaldehído, H2CO, compuesto utilizado para preparar polímeroscomo las resinas de melamina.
Solución:
La estructura de Lewis tiene un total de 12 electrones de valencia y un átomo central de C. Uniendo los átomos de hidrógeno y oxígeno al átomo central y verificando que carbono y oxígeno cumplan octeto ( el hidrógeno cumple dueto) se tiene |
|
Hay tres grupos de electrones en torno al átomo de C, dos grupos en los enlaces simples carbono - hidrógeno y el tercero en el enlace doble carbono - oxígeno. La geometría de grupos de electrones para tres grupos de electrones es trigonal plana. Como todos los grupos de electrones participan en enlaces, la notación RPECV para esta molécula es AX3. La geometría molecular es también trigonal plana.
Momento dipolar y geometría molecular
El momento dipolar es una medida cuantitativa del grado de separación de cargas en una molécula. La polaridad de un enlace, por ejemplo en HCl, se caracteriza por una separación de cargas eléctricas. Esto se puede representar indicando las cargas parciales + y - en los átomos. Cualquier molécula que tiene una separación neta de carga, como el HCl, tiene un momento dipolar distinto de cero y por lo tanto es una molécula polar. |
|
Se puede relacionar la presencia o ausencia de un momento dipolar en una molécula con su geometría molecular. Por ejemplo, la molécula de CO2. Cada enlace carbono - oxígeno, tiene una polaridad en la cual el átomo de oxígeno más electronegativo tiene una carga negativa parcial. |
| |||
Se representa la contribución al momento dipolar de cada enlace ( enlace dipolo)por una flecha con un signo positivo en un extremo , |
| Cada enlace dipolo, como una fuerza, es una cantidad vectorial; esto es, tiene magnitud y dirección. Como las fuerzas, dos enlaces dipolo de magnitud igual pero de dirección opuesta se cancelan entre sí. Debido a que los dos enlaces carbono - oxígeno en CO2 son iguales, pero en direcciones opuestas, dan un momento dipolar neto de cero para la molécula. | ||
| La molécula de H2O es una molécula polar, tiene un momento dipolar distinto de cero. El hecho de que la molécula de agua tenga un momento dipolar distinto de cero es una evidencia experimental excelente para la geometría angular. Si la molécula de H2O fuera lineal, el momento dipolar sería cero. | |||
Aquellas moléculas AXn (donde todos los átomos X son idénticos, como en el CCl4) en cuyas geometrías los enlaces A _ X están dirigidos simétricamente alrededor del átomo central (por ejemplo, lineal, plana trigonal y tetraédrica) dan moléculas de momento dipolar cero; esto es, las moléculas son no polares. |
| |||
8
Los átomos de carbono tiene cuatro electrones en su última capa, de modo que formando cuatro enlaces covalentes con otros átomos, consigue completar su octeto.
TIPOS DE ENLACE
- 4 Enlaces sencillos C-H,
- Ángulos de enlace 109º28′
- Orbitales híbridos sp3
- 1 Enlace doble C=C
- Ángulos de enlace de 120º
- Orbitales híbridos sp2
-1 enlace triple
-Ángulo de enlace de 180º
- Orbitales híbridos sp
Fórmula química
La fórmula química es la representación de los elementos que forman un compuesto y la proporción en que se encuentran, o del número de átomos que forman una molécula. También puede darnos información adicional como la manera en que se unen dichos átomos medianteenlaces químicos e incluso su distribución en el espacio. Para nombrarlas, se emplean las reglas de la nomenclatura o formulación química. Existen varios tipos de fórmulas químicas:1
Artículo principal: Fórmula empírica[editar]Fórmula empírica
La fórmula empírica indica el tipo de átomos presentes en un compuesto y la relación entre el número de átomos de cada clase. Siempre indica las proporciones enteras más pequeñas entre los átomos de cada clase.2
En compuestos covalentes, se obtiene simplificando los subíndices de la fórmula, si ello es posible, dividiéndolos por un factor común. Así la fórmula empírica de la glucosa es CH2O, lo cual indica que por cada átomo de C, hay dos átomos de H y un átomo de O. Los subíndices siempre son números enteros y si es igual a 1, no se escribe.
En compuestos iónicos la fórmula empírica es la única que podemos conocer, e indica la proporción entre el número de ionesde cada clase en la red iónica. En el hidruro de magnesio, hay dos iones hidruro (bolas blancas, en el diagrama) por cada ión magnesio (bolas verdes), luego su fórmula empírica es MgH2.
En compuestos no-estequiométricos, como ciertos minerales, los subíndices pueden ser números decimales. Así,el óxido de hierro (II) tiene una fórmula empírica que varía entre Fe0,84O y Fe0,95O,lo que indica la presencia de huecos, impurezas y defectos en la red.
[editar]Fórmula molecular
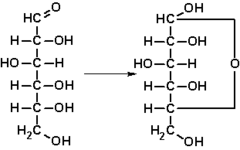
La fórmula molecular, indica el tipo de átomos presentes en un compuesto molecular, y el número de átomos de cada clase. Sólo tiene sentido hablar de fórmula molecular en compuestos covalentes. Así la fórmula molecular de la glucosa es C6H12O6, lo cual indica que cada molécula está formada por 6 átomos de C, 12 átomos de H y 6 átomos de O, unidos siempre de una determinada manera.
[editar]Fórmula semidesarrollada
La fórmula semidesarrollada es similar a la anterior pero indicando los enlaces entre los diferentes grupos de átomos para resaltar, sobre todo, los grupos funcionales que aparecen en la molécula. Es muy usada en química orgánica, donde se puede visualizar fácilmente la estructura de la cadena carbonada y los diferentes sustituyentes. Así, la glucosa tendría la siguiente fórmula semidesarrollada:
CH2OH − CHOH − CHOH − CHOH − CHOH − CHO
[editar]Fórmula desarrollada
La fórmula desarrollada es similar a la anterior pero indicando todos los enlaces. Aunque se representa sobre un plano, permite observar ciertos detalles de la estructura que resultan de gran interés. Se llaman también estructuras de Kekulé.
[editar]Fórmula estructural
La fórmula estructural es similar a las anteriores pero señalando la geometría espacial de la molécula mediante la indicación de distancias, ángulos o el empleo de perspectivas en diagramas bi- o tridimensionales.4
 |  |  |  |  |
|---|---|---|---|---|
| Fórmula desarrollada de H2O2 | Estructura mostrando ángulos y distancias | Fórmula estructural 2D del H2O2 | Modelo de bolas y varillas de H2O2 | Modelo de bolas 3D (Van der Waals) |
En un diagrama 2D, se aprecia la orientación de los enlaces usando símbolos especiales. Una línea continua representa un enlace en el plano; si el enlace está por detrás, se representa mediante una línea de puntos; si el enlace está por delante, se indica con un símbolo en forma de cuña triangular. A veces se emplean otro tipo de convenios o proyecciones para grupos de compuestos específicos (proyección de Newman,diagramas de Tollens, etc). En los diagramas adjuntos, se observan algunos de estas fórmulas estructurales.
También hay diagramas 3D como la estructura o fórmula de esqueleto (o de líneas y ángulos).
A veces, se prefiere el uso de modelos moleculares en 3D, como:
- Modelo de esqueleto, de armazón: no se dibujan los átomos de C e H.
- Modelo de bolas y barras, o de bolas y varillas.
- Modelo de bolas, compacto o espacial sólido.
- Modelos poliédricos: los átomos se representan por tetraedros, octaedros... que se unen por sus vértices y permiten ciertos giros o torsiones.
Isomería
La isomería es una propiedad de ciertos compuestos químicos que con igual fórmula química, es decir, iguales proporciones relativas de losátomos que conforman su molécula, presentan estructuras moleculares distintas y, por ello, diferentes propiedades. Dichos compuestos reciben la denominación de isómeros. Los isómeros son compuestos que tienen la misma fórmula molecular pero diferente fórmula estructural y, por tanto, diferentes propiedades. Por ejemplo, el alcohol etílico o etanol y el éter dimetílico son isómeros cuya fórmula molecular es C2H6O.
Aunque este fenómeno es muy frecuente en Química orgánica, no es exclusiva de ésta pues también la presentan algunoscompuestos inorgánicos, como los compuestos de los metales de transición.
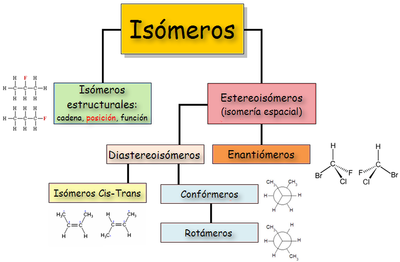
Hay dos tipos básicos de isomería: plana y espacial.1[editar]Isomería en Química Orgánica
[editar]Isomería plana o estructural
Forma de isomería, donde las moléculas con la misma fórmula molecular, tienen un diferente arreglo en los enlaces entre sus átomos, es lo opuesto a los estereoisómeros.
Debido a esto se pueden presentar 3 diferentes modos de isomería:
• Isomería de cadena o esqueleto.- Los isómeros de este tipo, tienen componentes de la cadena acomodados en diferentes lugares.
Un ejemplo es el pentano, del cual, existen muchos isómeros, pero los más conocidos son el isopentano y el neopentano
• Isomería de posición.- En donde, los grupos funcionales de unos compuestos, se unen de diferentes posiciones.
Un ejemplo simple de este tipo de isomería es la molécula del pentanol, donde e 3-pentanol.
• Isomería de grupo funcional.- Aquí, la diferente conectividad de los átomos, pueden generar diferentes grupos funcionales en la cadena. Un ejemplo es el ciclohexano y el 1-hexeno, que tienen la misma fórmula molecular (C6H12), pero el ciclohexano es un alcano cíclico o cicloalcano y el 1-hexeno es un alqueno. Hay varios ejemplos de isomeria como la de ionización,coordinación,enlace,geometría y óptica.
[editar]Isomería de cadena u ordenación
| Butano n-butano | Metilpropano iso-butano ó ter-butano |
|---|---|
 |  |
Varía la disposición de los átomos de C en la cadena o esqueleto carbonado, es decir la estructura de éste, que puede ser lineal o tener distintas ramificaciones.
Así, el C4H10 corresponde tanto al butano como al metilpropano (isobutano ó ter-butano):
Para la fórmula C5H12, tenemos tres posibles isómeros de cadena: pentano,metilbutano (isopentano) y dimetilpropano (neopentano). El número de isómeros de cadena crece rápidamente al aumentar el número de átomos de carbono.
[editar]Isomería de posición
| CH3-CH2-CH2-CH2OH | CH3-CH2-CHOH-CH3 |
|---|---|
| Butan-1-ol, 1-butanol o n-butanol | Butan-2-ol, 2-butanol o sec-butanol |
La presentan aquellos compuestos que poseen el mismo esqueleto carbonado pero en los que el grupo funcional o el sustituyente ocupa diferente posición.
El C4H10O puede corresponder a dos sustancias isómeras que se diferencian en la posición del grupo OH:
[editar]Isomería de función
| CH3-CH2-CH0 | CH3-CO-CH3 |
|---|---|
| Propanal (función aldehído) | Propanona (función cetona) |
Varía el grupo funcional, conservando el esqueleto carbonado.
El C3H6O puede corresponder a:
Esta isomería la presentan ciertos grupos de compuestos relacionados como: losalcoholes y éteres, los acidos y ésteres, y también los aldehídos y cetonas.
[editar]Tautomería
Es un tipo especial de isomería en la que existe transposición de un átomo entre las dos estructuras, generalmente hidrógeno,existiendo además un fácil equilibrio entre ambas formastautómeras2 Un ejemplo de la misma es la tautomería ceto-enólica en la que existe equilibrio entre un compuesto con grupo OH unido a uno de los átomos de carbono de un doble enlace C=C, y un compuesto con el grupo carbonilo intermedio, C=O típico de las cetonas, con transposición de un átomo de hidrógeno.
[editar]Isomería espacial o estereoisomería
Presentan estereoisomería aquellos compuestos que tienen fórmulas moleculares idénticas y sus átomos presentan la misma distribución (la misma forma de la cadena; los mismos grupos funcionales y sustituyentes; situados en la misma posición), pero su disposición en el espacio es distinta.
Los isómeros tienen igual forma en el plano. Es necesario representarlos en el espacio para visualizar las diferencias. Puede ser de dos tipos: isomería conformacional e isomería configuracional, según que los isómeros se puedan convertir uno en otro por simple rotación de enlaces simples, o no.
[editar]Isomería conformacional
En este tipo de isómeros conformacionales3 o confórmeros, la conversión de una forma en otra es posible pues la rotación en torno al eje de los átomos de carbono es más o menos libre (ver animación a la derecha). Por eso también reciben el nombre derotámeros. Si los grupos son voluminosos podría haber impedimento estérico y no ser tan fácil la interconversión entre rotámeros.
Estas formas se reconocen bien si utilizamos la proyección de Newman, como se aprecia en los dibujos de la izquierda. Reciben nombres como sinclinal (a veces, gauche), anticlinal (anti o trans), sinperiplanar y antiperiplanar.3
Otro tipo de isómeros conformacionales se da en compuestos con ciclos hexagonales,como el ciclohexano, donde son factibles la conformación en forma de silla y conformación en forma de bote.
[editar]Isomería configuracional
No basta una simple rotación para convertir una forma en otra y aunque la disposición espacial es la misma,los isómeros no son interconvertibles. Se divide en: isomería geométrica o cis-trans, e isomería óptica.
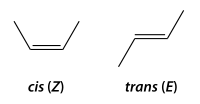
Isomería geométrica o cis-trans
Se produce cuando hay dos carbonos unidos con doble enlace que tienen las otras valencias con los mismos sustituyentes (2 pares) o con dos iguales y uno distinto.
No se presenta isomería geométrica ligada a los enlaces triples o sencillos.
A las dos posibilidades se las denomina:
- forma cis (o forma Z), con los dos sustituyentes más voluminosos del mismo lado, y
- forma trans (o forma E), con los dos sustituyentes más voluminosos en posiciones opuestas.
No se pueden interconvertir entre sí estas dos formas de un modo espontáneo, pues el doble enlace impide la rotación, aunque sí pueden convertirse a veces, en reacciones catalizadas.
| Isómeros del But-2-eno | Ácido maleico (Cis) y ácido fumárico (trans) | Formas trans (E) y cis (Z) del 1,2-dibromoeteno. |
|---|---|---|
 |  |
La isomería geométrica también se presenta en compuestos con doble enlace N=N, o en compuestos cíclicos en los que también se impide la rotación en torno a un eje.
| 1,2-dimetilciclopentano (formas cis y trans) | cis-1,2-diclorociclohexano | trans-1,2-diclorociclohexano | Formas cis y trans del difluorodiazeno |
|---|---|---|---|
 |  |  |  |
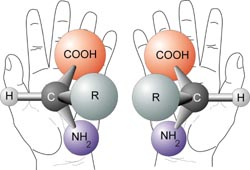
Isomería óptica o Enantiomería
Cuando un compuesto tiene al menos un átomo de Carbono asimétrico o quiral, es decir, un átomo de carbono con cuatro sustituyentes diferentes, pueden formarse dos variedades distintas llamadas estereoisómeros ópticos, enantiómeros, formas enantiomórficas o formas quirales, aunque todos los átomos están en la misma posición y enlazados de igual manera. Esto se conoce como regla de Level y Van't Hoff.1
Los isómeros ópticos no se pueden superponer y uno es como la imagen especular del otro, como ocurre con las manos derecha e izquierda. Presentan las mismas propiedades físicas y químicas pero se diferencian en que desvían el plano de la luz polarizada en diferente dirección: uno hacia la derecha (en orientación con las manecillas del reloj) y se representa con la letra (D) o el signo (+)(isómero dextrógiro o forma dextro) y otro a la izquierda (en orientación contraria con las manecillas del reloj)y se representa con la letra (L) o el signo (-)(isómero levógiro o forma levo).4
Si una molécula tiene n átomos de Carbono asimétricos, tendrá un total de 2n isómeros ópticos.
También pueden representarse estos isómeros con las letras (R) y (S). Esta nomenclatura se utiliza para determinar la configuración absoluta de los carbonos quirales.
Así pues,hay tres sistemas de nombrar estos compuestos: según la dirección de desviación del plano de la luz polarizada (Formas + y -); según la configuración (Formas D y L) y según la configuración absoluta (formas R y S).
Diasteroisómeros
Cuando un compuesto tiene más de un carbono asimétrico podemos encontrar formas enatiómeras (que son imagen especular una de la otra) y otras formas que no son exactamente copias espaculares, por no tener todos sus carbonos invertidos. A estas formas se les llamadiasteroisómeros. Por ejemplo, el 3-bromo-butan-2-ol posee dos carbonos asimétricos por lo que tiene 4 formas posibles. De ellas, algunas son enantiomorfas (formas especulares), como (2S,3S)-3-bromo-butan-2-ol y (2R,3R)-3-bromo-butan-2-ol. En cambio, (2R,3S)-3-bromo-butan-2-ol es un diastereoisómero de los dos anteriores.
Mezcla racémica y formas meso
Una mezcla racémica es la mezcla equimolecular de los isómeros dextro y levo. Esta fórmula es ópticamente inactiva (no desvía el plano de la luz polarizada). La mezcla de ácido D-láctico y L-láctico forma una mezcla racémica, ópticamente inactiva.
Si un compuesto posee dos carbonos asimétricos, puede tener uno dextrógiro y otro levógiro, pero si tiene un plano de simetría, en conjunto se comporta como ópticamente inactivo y recibe el nombre deforma meso. Es el caso del ácido tartárico o 2,3-dihidroxibutanodioico, uno de cuyos isómeros es una forma meso.
Poder rotatorio específico Es la desviación que sufre el plano de polarización al atravesar la luz polarizada una disolución con una concentración de 1 gramo de sustancia por cm³ en un recipiente de 1 dm de anchura. Es el mismo para ambos enantiómeros, aunque de signo contrario. Se mide con el polarímetro.5
[editar]Isomería en Química Inorgánica
Hay varios tipos de isomeria presente en compuestos inorgánicos, sobre todo en complejos de coordinación,6 pero este fenómeno no es tan importante como en química orgánica:
- Isomería estructural o topológica: Los átomos se unen de modo diferente, como en el S2F2, de los que existe una molécula en forma de cadena y otra en forma de pirámide triangular. Un caso especial es la tautomería, en la que un átomo de H cambia de posición.
- Isomería conformacional: Igual a la ya comentada para compuestos orgánicos. Se presenta en compuestos con enlace sencillo como P2H4 o el ión ditionito, S2O42-, donde existen formas eclipsadas, escalonadas y sinclinal (gauche).
- Isomería cis-trans (geométrica): Aparece en compuestos como el ácido nitroso, HNO2, o en complejos de coordinación plano-cuadrados como [PtCl2(NH3)2].
- Isomería de posición, como en algunos heterociclos de azufre y nitrógeno. En el S6(NH)2 se mantiene el anillo octogonal del azufre pero dos átomos de azufre han sido sustituidos por grupos NH,que pueden estar en posición 1,2; 1,3; 1,4 y 1,5.
- Isomería óptica: también aparece en compuestos de coordinación de estructura tetraédrica con sustituyentes diferentes.
- Isomería de ionización: Se intercambian un ligando del catión con uno delos aniones que loneutralizan,como ocurre entre [CrSO4(NH3)5]Cl y [CrCl(NH3)5]SO4
- Isomería de coordinación: Si ambos iones son complejos, podemos intercambiar sus ligandos y obtendremos isómeros diferentes, como ocurre entre [Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6].
- Isomería de enlace: Algunos ligandos pueden unirse de modo diferente al ión central,como ocurre en [CoCl(NO2)(NH3)4]+ [CoCl(ONO)(NH3)4]+7
- Isomería de polimerización: Es el caso de NO2 y N2O4, dos óxidos de nitrógeno gaseosos.
| Isómeros geométricos o cis - trans |  |  |
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono.  Isomeros geométricos Los compuestos cíclicos, debido a su rigidez, también presentan isomería geométrica. Así, el 1,2-dimetilciclohexano puede existir en forma de dos isómeros. Se llama isómero cis el que tiene los hidrógenos al mismo lado y trans el que los tiene a lados opuestos.  Carbono asimétricoUn carbono asimétrico o carbono quiral es un átomo de carbono que está enlazado con cuatro elementos diferentes. Puede presentarse en algunoscompuestos orgánicos, sobre todos en aquellos que están presentes en los seres vivos, como los carbohidratos. La presencia de uno o varios átomos de carbono asimétrico en un compuestoquímico es responsable de la existencia de isomería óptica. Cada una de las dos estructuras diferentes que pueden formarse tienen los mismos átomos y los mismos enlaces pero no pueden superponerse una sobre otra, como ocurre con las dos manos de una persona. Se llaman enantiómeros y se diferencian en la dirección en la que desvían la luz polarizada por lo que se llaman formas ópticamente activas. Antecedentes Las Fuerzas Intermoleculares, son fuerzas de atracción y repulsión entre las moléculas. El comportamiento molecular depende en gran medida del equilibrio (o falta de él) de las fuerzas que unen o separan las moléculas, y el estudio de esos fenómenos fue parte importante del desarrollo de la química física en el siglo XX. Las fuerzas de atracción explican la cohesión de las moléculas en los estados liquido y sólido de la materia, y se llaman fuerzas de largo alcance o Fuerzas de Van der Waals en honor al físico holandés Johannes van der Waals. Estas fuerzas son las responsables de muchos fenómenos físicos y químicos como la adhesión, rozamiento, difusión, tensión superficial y la viscosidad. Entre las diferentes fuerzas de orden intermoleculares que mantienen unidos los átomos dentro de la molécula y mantener la estabilidad de las moléculas individuales. Hay varios tipos de interacciones: -Fuerzas de orientación (aparecen entre moléculas con momento dipolar diferente) -Fuerzas de inducción (ion o dipolo permanente producen en una molécula apolar una separación de cargas por el fenómeno de inducción electrostática) -Fuerzas de dispersión (aparecen en tres moléculas apolares). En la naturaleza, las uniones entre molécula son de tipo dipolar, siendo las más características las fuerzas de Van der Waals y los puentes de hidrógeno. Las fuerzas de atracción entre moléculas (monoatómicas o poliatómicas) sin carga neta se conocen con el nombre de fuerzasintermoleculares o fuerzas de van der Waals. Dichas fuerzas pueden dividirse en tres grandes grupos: las debidas a la existencia dedipolos permanentes, las de enlace de hidrógeno y las debidas a fenómenos de polarización transitoria (fuerzas de London). A continuación realizaremos un estudio elemental de cada uno de dichos grupos. Fuerzas de Van der Waals: Es una fuerza intermolecular atractiva, pero poco intensa, que se ejerce a distancia entre moléculas. Son fuerzas de origen eléctrico que pueden tener lugar entre dipolos instantáneos o inducidos y entre dipolos permanentes. Las sustancias moleculares están formadas por moléculas individuales entre las que únicamente existen interacciones de tipo residual que son las responsables del enlace conocido como fuerza de Van der Waals. Pero este tipo de fuerza no sólo está presente en los sólo los sólidos moleculares, sino que también aparece entre los átomos o iones sometidos a cualquier clase de enlace, ya sea iónico, metálico o covalente; por eso se considera como una interacción residual. Su energía es mucho menor que la de los otros tipos de enlace y normalmente aparezca enmascarada. Por otra parte, la interacción conocida como fuerza de Van der Waals se caracteriza también porque carece de carácter dirigido y porque opera a distancias mucho mayores. Las fuerzas de Van der Waals pueden llegar a mantener ordenaciones cristalinas, pero los puntos de fusión de las sustancias covalentes son siempre bajos, ya que la agitación térmica domina; las fuerzas de Van der Waals son las únicas responsables de la estabilidad de estos gases nobles en estado sólido. La mayor parte de las sustancias covalentes, a temperatura ambiente, son los gases o líquidos de punto de ebullición bajo (ejemplo: Agua). En cuanto a la solubilidad, puede decirse que, en general, las sustancias covalentes son solubles en disolventes apolares y no en disolventes polares. Se conocen algunos sólidos covalentes prácticamente infusibles e insolubles, que son excepción al comportamiento general descrito. Un ejemplo de esto es el diamante. La gran estabilidad de estas redes cristalinas se debe a que los átomos que las forman están unidos entre sí mediante enlaces covalentes. Para deshacer la red, es necesario romper estos enlaces, lo cual consume gran cantidad de energía. Las fuerzas entre dipolos instantáneos o inducidos se producen entre moléculas apolares como es el caso del oxigeno, nitrógeno o cloro, y también entre átomos como el helio o neòn, y reciben el nombre de fuerzas de dispersión. Este tipo de fuerzas es el responsable de que estas sustancias pueden ser licuadas e incluso solidificadas. Las nubes electrónicas de las moléculas o delos átomos sufren vibraciones y producen dipolos con una orientación determinada, pero de vida muy breve ya que en un instante después el dipolo tiene la orientación contraria. Estos dipolos inducen otra deformación en las moléculas contiguas y originan fuerzas de atracción entre ellas.
Las fuerzas entre dipolos permanentes se producen cuando las moléculas son polares, como el oxido de azufre (SO2) o el monóxido de carbono (CO), y existe atracción entre el polo de una molécula y el polo opuesto de otra molécula contigua. Estas fuerzas siguen siendo débiles pero son más intensas que las fuerzas de dispersión y, aunque éstas siguen existiendo, predominan las de atracción dipolo-dipolo. Enlace dipolo-dipolo: Existen gases cuyas moléculas están formadas por átomos que tienen diferente electronegatividad (enlace covalente polar) y que se hallan dispuestos de forma que en la molécula existen zonas con mayor densidad de electrones que otras (polo negativo y positivo respectivamente). Este es el caso, por ejemplo, de los gases fluoruro de hidrógeno (HF), cloruro de hidrógeno (HCl), bromuro de hidrógeno (HBr) y ioduro de hidrógeno (HI). Ejemplo: La molécula de agua está formada por dos átomos de H unidos a un átomo de O por medio de dos enlaces covalentes. La disposición tetraédrica de los orbitales sp3 deloxígeno determina un ángulo entre los enlaces H-O-H aproximadamente de 104'5:, además el oxígeno es más electronegativo que el hidrógeno y atrae con más fuerza alos electrones de cada enlace.
El resultado es que la molécula de agua aunque tiene una carga total neutra (igual número de protones que de electrones ), presenta una distribución asimétrica de sus electrones, lo que la convierte en una molécula polar, alrededor del oxígeno se concentra una densidad de carga negativa , mientras que los núcleos de hidrógeno quedan desnudos, desprovistos parcialmente de sus electrones y manifiestan, por tanto, una densidad de carga positiva. Por eso en la práctica la molécula de agua se comporta como un dipolo.
Así se establecen interacciones dipolo-dipolo entre las propias moléculas de agua, formándose enlaces o puentes de hidrógeno, la carga parcial negativa del oxígeno de una molécula ejerce atracción electrostática sobre las cargas parciales positivas de los átomos de hidrógeno de otras moléculas adyacentes. Puente de Hidrógeno: La unión intermolecular por puentes de hidrógeno se produce en moléculas formadas por átomos de hidrógeno y elementos de elevada electronegatividad y tamaño pequeño, como es el caso del flúor, oxigeno o nitrógeno (que son los únicos elementos cuyos átomos pueden formar puentes de hidrógeno), el par de electrones que forma el enlace esta fuertemente atraído por el átomo más electronegativo, produciéndose una polarización del enlace. Esto proporciona una carga parcial positiva al átomo de H y una carga parcial negativa al otro átomo. En virtud de estas cargas, puede establecerse atracción eléctrica entre los hidrógenos de una molécula y los átomos electronegativos de una molécula vecina. Como el enlace de Van der Waals, el puente de hidrógeno es mucho menos energético que el enlace covalente o el iónico, con los valores de entre 1 y 10 Kcal/mol. Un ejemplo lo encontramos en la molécula de agua, donde los electrones de la unión H-O se encuentran fuertemente atraídos por el átomo de oxigeno. Por ello, el núcleo de hidrógeno H+ va a actuar como polo positivo de gran intensidad que establece uniones de tipo electrostático con los átomos de oxigeno de las moléculas cercanas. Gráficamente, la unión del puente de hidrógeno se representa mediante una línea de puntos.
El enlace anterior entre el oxígeno y el hidrógeno de moléculas de agua distintas (representado aquí por una línea punteada) recibe el nombre de enlace de hidrógeno. Un enlace de hidrógeno es una unión de tipo intermolecular generada por un átomo de hidrógeno que se halla entre dos átomos fuertemente electronegativos. De hecho sólo los átomos de F, O y N tienen la electronegatividad y condiciones necesarias para intervenir en un enlace de hidrógeno. La clave de la formación del enlace de hidrógeno es el carácter fuertemente polar del enlace covalente entre el hidrógeno H y otro átomo (por ejemplo O). La carga parcial positiva originada en el átomo de hidrógeno atrae a los electrones del átomo de oxígeno de una molécula vecina. Dicha atracción se ve favorecida cuando ese otro átomo es tan electronegativo que tiene una elevada carga parcial negativa. El hidrógeno es el único átomo capaz de formar este tipo de enlace porque al ser tan pequeño permite que los otros átomos más electronegativos de las moléculas vecinas puedan aproximarse lo suficiente a él como para que la fuerza de atracción sea bastante intensa. Este tipo de enlace intermolecular es el responsable, por ejemplo, de la existencia de océanos de agua líquida en nuestro planeta. Si no existiera, el agua se encontraría en forma de vapor. | ||||||||||||||||||||||||||











































No hay comentarios:
Publicar un comentario